
【题目】实验室中,利用下列装置可以制取某些气体。请回答下列问题。
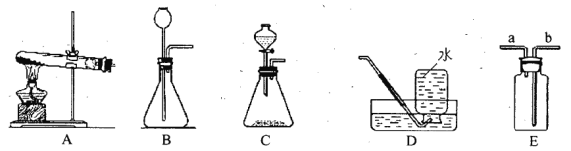
(1)实验室制取CO2的化学方程式为_________。若用E装置收集,则进气管是________(填 “a”或“b”)。(2)若选用装置C和D组合制取并收集O2,反应的化学方程式为_________________,该反应__________________(填“吸收”或“放出”)热量。若锥形瓶内反应过于剧烈,可采取的方法有________________(任写一种)。
(3)查阅资料可知,高铁酸钾(K2FeO4)固体可用于制取氧气。
方案一: 4K2FeO4 ![]() 2Fe2O3+4K2O+3O2
2Fe2O3+4K2O+3O2![]()
方案二: 4K2FeO4+10H2O===4Fe(OH)3![]() +8KOH+3O2
+8KOH+3O2![]()
Ⅰ.若用方案一制取氧气,应该选用的发生装置是___________(选填装置序号)。
Ⅱ.下列关于以上两种方案制取氧气的说法正确的是___________(选填数字序号)。
①方案一发生的是分解反应
②方案二更简便、节能
③制取等质量的氧气,两种方案所需高铁酸钾的质量相等
【答案】CaCO3+2HCl=CaCl2+H2O+CO2↑ b 2H2O2![]() 2H2O+O2↑ 放热 减小滴加液体的速率或者将过氧化氢溶液加水稀释 A ①②③
2H2O+O2↑ 放热 减小滴加液体的速率或者将过氧化氢溶液加水稀释 A ①②③
【解析】
(1)实验室常用石灰石和稀盐酸反应制取CO2,原理是碳酸钙和稀盐酸反应生成二氧化碳、氯化钙、水,化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑;若用E装置收集,由于二氧化碳的密度比空气的大,则进气管是b;
(2)过氧化氢法制氧气常选用装置C和D组合,过氧化氢在二氧化锰的作用下分解生成水和氧气,反应的化学方程式为2H2O2![]() 2H2O+O2↑,该反应放出热量。若锥形瓶内反应过于剧烈,可采取的方法有:控制分液漏斗的活塞,减小滴加液体的速率或者将过氧化氢溶液加水稀释;
2H2O+O2↑,该反应放出热量。若锥形瓶内反应过于剧烈,可采取的方法有:控制分液漏斗的活塞,减小滴加液体的速率或者将过氧化氢溶液加水稀释;
(3)由题中信息可知:方案一:4K2FeO4![]() 2Fe2O3+4K2O+3O2
2Fe2O3+4K2O+3O2![]()
方案二:4K2FeO4+10H2O===4Fe(OH)3![]() +8KOH+3O2
+8KOH+3O2![]()
Ⅰ.方案一是加热固体制取氧气,应该选用的发生装置是固-固加热型A;
Ⅱ.①方案一发生的是由一种物质生成多种物质的分解反应;
②方案二不需要加热,更简便、节能
③由化学方程式可知,两种设计方案涉及到的高铁酸钾和氧气的质量比相同,制取等质量的氧气,两种方案所需高铁酸钾的质量相等。


 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:初中化学 来源: 题型:
【题目】用下图装置(夹持仪器略去)探究燃烧的条件。实验过程及现象:①打开弹簧夹,通入N2,点燃酒精灯,加热一段时间,红磷和白磷均不燃烧;②熄灭酒精灯,改通O2,白磷燃烧,红磷不燃烧。
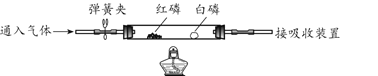
(1)实验过程中,能说明可燃物燃烧需要氧气的实验现象是______。
(2)实验②中,红磷不燃烧的原因是______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据如图所示的实验回答问题。
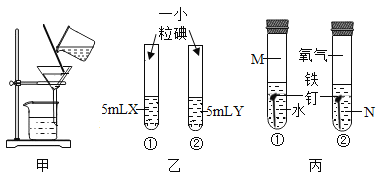
(1)天然水中含有许多杂质,将天然水变成纯水的方法是_____实验室用甲装置除去浑浊的河水中的泥沙时,最好先将上层液体倒入过滤器,然后再倒入混有沉淀的液体,以免_____,使过滤速度过慢。
(2)乙图中X、Y分别是水和汽油中一种,各加入一小粒碘后,观察到①中固体消失并得到棕色溶液,②中固体不消失,则物质X是_____由实验可知,物质的溶解性与_____有关。
(3)铁制品锈蚀的过程,实际上是铁与空气中的_____等发生反应的过程。丙是探究影响铁锈蚀快慢因素的实验,为探究氯化钠是否能加快铁的锈蚀,试管①中的物质M是_____,试管②中的物质N是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】山药中含有“药用黄金”薯蓣皂素(化学式为C27H42O3)。下列有关薯蓣皂素的说法正确的是
A. 薯蓣皂素属于氧化物
B. 207g薯蓣皂素中含有8g的氧元素
C. 薯蓣皂素中碳、氢元素的质量比为54:7
D. 薯蓣皂素是由27个碳原子、42个氢原子和3个氧原子构成的
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图为某反应的微观示意图,其中“![]() ”和“
”和“![]() ”表示不同元素的原子。下列说法正确的是
”表示不同元素的原子。下列说法正确的是
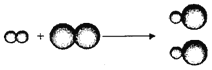
A. 反应前后元素的种类发生改变
B. 反应前后分子种类没有改变
C. 该反应属于置换反应
D. 参加反应的两种分子个数比为1:1
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是A、B、C三种物质的溶解度曲线图,下列说法一定正确的是
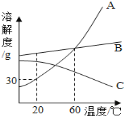
A. 将三种物质的饱和溶液分别由60℃降温到20℃,A溶液中析出的晶体质量最大
B. C可能是氢氧化钙溶液
C. 采用蒸发结晶的方法除去A溶液中混有的少量B
D. 60℃时,等质量的A、C饱和溶液中,水的质量是A<C
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】黄铜渣中约含 Zn7%,ZnO 31%,Cu 50%,CuO 5%,其余为杂质。处理黄铜渣可得到硫酸锌,其主要流程如下(杂质不溶于水、不参与反应) (查阅资料) ZnO+H2SO4=ZnSO4+H2O CuO+H2SO4=CuSO4+H2O 下列说法不正确的是
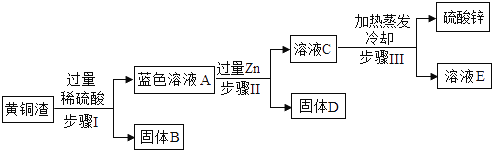
A. 步骤Ⅰ、步骤Ⅱ中的操作均包含过滤 B. 步骤Ⅰ、步骤Ⅱ过程中均有无色气泡生成
C. 固体B和固体D中均含有铜 D. 溶液 C中溶质至少还有2种
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】初三化学学习小组开展以下探究。(1)实验室制取常见气体
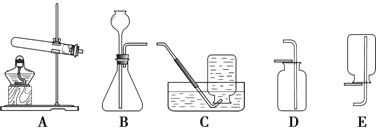
①用高锰酸钾制取氧气可用_____(填标号,下同),用双氧水制取氧气可用______,制取二氧化碳气体可用_____。
a.AC组合 b.BD组合 c.BE组合
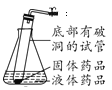
②如图所示是方方同学利用报废试管设计的制二氧化碳的发生装置,装置中反应的化学方程式为____。该设计除了废物利用的优点外,请另写一个优点:______。
(2)同学们设计以下实验方案对“影响金属与盐酸反应剧烈程度的因素”进行了探究(盐酸的质量相同且足以把金属完全消耗)。
实验编号 | 金属 | 盐酸的质量分数/% | 温度/℃ | 金属丝消失的时间/s |
1 | 铝丝 | 5 | 20 | 450 |
2 | 铝丝 | 8 | 20 | t |
3 | 铝丝 | 10 | 20 | 240 |
4 | 铝丝 | 10 | 30 | 65 |
5 | 铁丝 | 10 | 30 | 125 |
①上表中还要注明控制的变量是_______。
②铝与盐酸反应的化学方程式为_______。
③实验1、2、3的目的是_____;在实验2中,铝丝消失的时间(用t表示)的取值范围是_____。
④为了比较盐酸与金属反应的剧烈程度,除了用金属丝消失的时间作为观测指标外,还可以选择___。
⑤由实验_____(填实验编号)可知,温度对金属与酸反应速率的影响是____。
⑥实验4、5说明金属与盐酸反应剧烈程度与金属的种类有关,通过这两个实验可知铝的活泼性比铁____(填“强”或“弱”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】“铜绿”受热时发生如下反应:Cu2(OH)2CO3 ![]() 2X + CO2 ↑ + H2O。下列有关说法正确的是
2X + CO2 ↑ + H2O。下列有关说法正确的是
A. X的化学式为Cu2O B. 反应前后元素的种类发生改变
C. 反应后固体质量减少,不遵守质量守恒定律 D. 反应后固体中铜元素的质量分数增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com