
| A. |  检查装置气密性 | B. |  滴加液体 | C. | 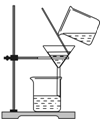 过滤 | D. |  点燃酒精灯 |
 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:实验探究题

| 物质 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 | Cu(OH)2 |
| 开始沉淀时pH | 6.34 | 1.48 | 6.2 | 5.2 |
| 完全沉淀时pH | 9.7 | 3.2 | 8.0 | 6.4 |
| Fe(OH)2是一种絮状沉淀,不易除去,处理时常将其转化为Fe(OH)3而除去. | ||||
| 装置C的质量(/g) | 装置D的质量(/g) | |
| 实验前 | 198.4 | 235.7 |
| 实验后 | 209.2 | 244.5 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 碱溶液一定呈碱性,呈碱性的溶液不一定是碱溶液 | |
| B. | 置换反应一定有单质和化合物生成,有单质和化合物生成的反应不一定是置换反应 | |
| C. | 酸雨一定呈现酸性,呈现酸性的雨不一定是酸雨 | |
| D. | 单质一定是含一种元素的纯净物,纯净物含有一种元素不一定是单质 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
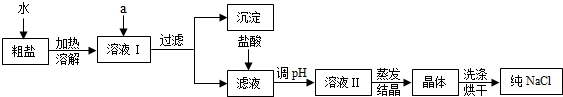
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
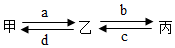 由分子构成的甲、乙、丙三种物质转化关系如图所示,甲和丙是氧化物,乙为单质,甲通过光合作用可得到乙,丙的相对分子质量最小,则甲的化学式为CO2,b、d两反应的化学方程式分别为2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2.
由分子构成的甲、乙、丙三种物质转化关系如图所示,甲和丙是氧化物,乙为单质,甲通过光合作用可得到乙,丙的相对分子质量最小,则甲的化学式为CO2,b、d两反应的化学方程式分别为2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 具有均一性、稳定性的液体一定是溶液 | |
| B. | 配制溶液时,搅拌可以增大固体溶质的溶解量 | |
| C. | 饱和溶液就是不能再溶解任何物质的溶液 | |
| D. | 溶液都是由溶质和溶剂组成的 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 含4个氢原子 | B. | 硼元素的化合价为+3 | ||
| C. | 只含一种非金属元素 | D. | Na、B、H的质量比为1:1:4 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com