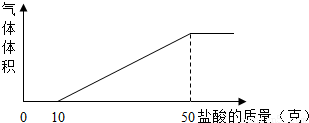
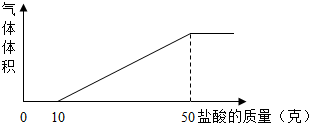
解:(1)根据图象可知生成二氧化碳的盐酸的用量是50g-10g=40g
设加入50克盐酸时产生的二氧化碳的质量是x,碳酸钠的质量是y;
Na
2CO
3+2HCl=2NaCl+H
2O+CO
2↑
106 73 44
y 40g×18.25% x
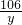
=

=
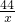
x=4.4g
y=10.6g
则产生的二氧化碳的体积是
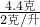
=2.2升
(2)由图象可知一开始加入盐酸并无二氧化碳生成说明溶液中存在氢氧化钠,氢氧化钠溶液通入二氧化碳时会有碳酸钠,所以甲溶液中含有氢氧化钠和碳酸钠;
由(1)知溶液中的碳酸钠的质量为10.6g;
设氢氧化钠的质量是z
NaOH+HCl═NaCl+H
2O
40 36.5
z 10g×18.25%
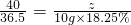
z=2g
(3)设原NaOH溶液的溶质的质量为w,由于氢氧化钠和碳酸钠与盐酸反应均可生成氯化钠,所以由原子守恒可得 NaCl~HCl~NaOH的关系式;
则由原子守恒可得 NaCl~HCl~NaOH,
36.5 40
50.0g×18.25% w

w=10g
所以原来氢氧化钠溶液的质量分数
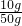
×100%=20%
故答案为:(1)加入50克盐酸时产生的二氧化碳的体积是2.2升;
(2)甲溶液中的溶质种类是氢氧化钠和碳酸钠,其质量分别为10.6g和2g;
(3)原来氢氧化钠溶液的质量分数为20%;
分析:(1)根据对图象的分析判断盐酸的用量,并依据化学方程式的计算完成即可;
(2)依据盐酸的用量图示可以看到一开始加入盐酸并无二氧化碳生成,可知溶液中还含有氢氧化钠,据此分析即可;
(3)依据过程中的反应可知盐酸最后中的氯元素最后都转化为氯化钠,可依据化学方程式的情况并建立三者之间的关系式,据此分析解答即可;
点评:本题难度较大,主要考查了图象和数据的分析及根据化学方程式进行计算,注意守恒法在解答中的应用,需明确反应后溶质的可能成分来计算.

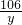 =
= =
=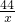
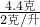 =2.2升
=2.2升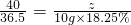

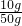 ×100%=20%
×100%=20%