
分析 化学变化是指有新物质生成的变化,物理变化是指没有新物质生成的变化,化学变化和物理变化的本质区别是否有新物质生成;物理性质是不需要发生化学变化就能表现出现的性质,如颜色、状态、味道、溶解性等等;化学性质是物质在化学变化中表现出来的性质,如可燃性、稳定性等等;性质和变化,性质是特性,变化是过程,描述性质一般用“能、易、难、会、可以”等.
解答 解:(1)氮气是无色无味的气体,属于物质的颜色、状态、气味属于物理性质;
(2)煤气燃烧生成二氧化碳和水,有新物质生成属于化学变化;
(3)水沸腾变成水蒸气,只是状态发生改变,没有新物质生成,属于物理变化;
(4)铁丝能在氧气中剧烈燃烧,必须通过化学变化才能表现出来,属于化学性质.
故答案为:(1)物理性质;(2)化学变化;(3)物理变化;(4)化学性质.
点评 本题难度不大,解答本题的关键是要充分理解两种变化和两种性质的含义和区分方法.


 应用题作业本系列答案
应用题作业本系列答案科目:初中化学 来源: 题型:多选题
| A. | 铝与氧气在常温下不能反应,而铁与氧气在高温时才能反应,故铝比铁活泼 | |
| B. | 锌片与盐酸反应比铁片与稀硫酸反应要剧烈,故锌比铁活泼 | |
| C. | 镁能与盐酸反应放出氢气,而铜不能与盐酸反应,故镁比铜活泼 | |
| D. | 铜与硝酸银溶液反应得到银,故铜比银活泼 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 物质(括号内为杂质) | 所用试剂及方法 | |
| A | H2O(H2O2) | MnO2过滤 |
| B | 除去CO中的少量H2O和CO2 | 先通过浓H2SO4,再通过NaOH溶液 |
| C | CO2(CO) | 过量O2点燃 |
| D | Al(Al2O3) | 足量稀H2SO4 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 化学变化多姿多彩,美丽如花.图中甲、乙、丙、X分别是Fe2O3、C、CO、盐酸中的某一种,甲、乙、丙均能与X发生化学反应,则X是( )
化学变化多姿多彩,美丽如花.图中甲、乙、丙、X分别是Fe2O3、C、CO、盐酸中的某一种,甲、乙、丙均能与X发生化学反应,则X是( )| A. | C | B. | Fe2O3 | C. | CO | D. | 盐酸 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.
化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.| 实验编号 | 选用金属(均取2g) | 盐酸质量分数(均取50mL) | 每分钟产生氢气的体积/mL | |||||
| 1分钟 | 1-2分钟 | 2-3分钟 | 3-4分钟 | 4-5分钟 | 前5分钟共收集气体 | |||
| Ⅰ | 锌片 | 15% | 2.9 | 16.9 | 11.9 | 9.2 | 7.6 | 48.5 |
| Ⅱ | 锌片 | 5% | 1.6 | 8.4 | 5.9 | 4.8 | 3.7 | 24.4 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用NaOH溶液除去CO2中混有的HCl | |
| B. | 用水除去MnO2中混有的KCl | |
| C. | 用点燃的方法除去CO2中混有少量的CO | |
| D. | 用硝酸除去NaCl中混有的Na2CO3 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
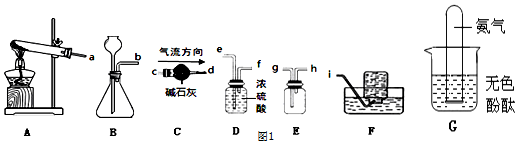
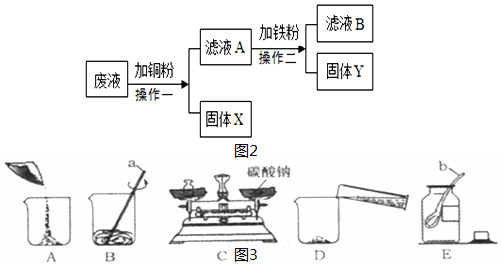
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com