
����Ŀ���Ķ����ڡ�21���͵���Դ��������ﮣ�Li�����Ŀ��ն��ģ��ش����⡣
���һ������ɫ�������ʽ������ܶȱ����е��Ͷ�С����Ӧ�����Һ̬ʯ���С������ϡ����Ѹ�ٷ�Ӧ��������ﮣ�Li2SO4������������ˮ��Ӧ����������﮺����������ҷų�������1800�귢�������ϵ�һ����أ�����½�������˸ɵ�ء�Ǧ���ء�﮵����21���Ͳ����ƿ�����������Դ���Ǻ���ǰ;�Ķ�����ء���ǰ�ֻ��й㷺ʹ�õĵ�ء���Ҫ�Ǹ���﮵�ء���﮵�ط����������������г���ֻ����ͨ���ͷ���������1/3��﮵�ضԻ�����Ӱ�첻����������ʹ�úͱ��϶��������κ�Ǧ�������ӵ��ж��к��ؽ���Ԫ�غ����ʡ�
��1�����ݶ������ݹ��ɳ�﮵���������_____��дһ�㣩��
��2���û�ѧ����ʽ��ʾ﮵�һ����ѧ����_____��
��3�����ݶ��������жϣ���Ż���_____����ܡ����ܡ�����ˮ���������������Li��Hg�Ľ��������ǿ������˳����_____��
��4���ֻ����綯���г����綯�����㷺ʹ��﮵�ص��ŵ���_____��
���𰸡������壨���ܶȱ���С�� ![]() ��
�� ![]() ���� Li��Hg �Ի�������Ⱦ
���� Li��Hg �Ի�������Ⱦ
��������
��1�����������Dz���Ҫ������ѧ�仯�ͱ��ֳ��������ʣ�����﮵����������ǣ�����ɫ�������ܶȱ���С��
��2��﮺�ˮ��Ӧ����������﮺������������ϡ����Ѹ�ٷ�Ӧ��������﮺���������ѧ����ʽΪ��![]() ��
��![]() ��
��
��3����Ż��˲�����ˮ���ԭ���������ˮ��Ӧ�������������������ϡ����Ѹ�ٷ��������������ᷴӦ�����ʣ���֪﮵Ľ�����Աȹ�ǿ��
��4��﮵�ع㷺�����ֻ����綯���г����綯�����ĺô��ǶԻ�������Ⱦ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
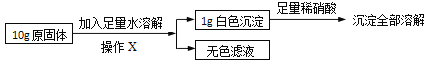
����Ŀ���ҹ���ѧ�Һ�°��ڰ���Ļ����ϴ����˸�Ϊ�Ƚ��������Ƽ�������Ƽ�������������̼�����ͼ1��
���ʶ����ͼ���ش��������⣺
��1��д���������з�����Ӧ�Ļ�ѧ����ʽ______��
��2����������������X�Ļ�ѧʽ��______��
��3���������о���ת��������¯ʱ�õ������٣������ٵ�������______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������һ������ҩƷ�����ܺ���BaSO4��Na2CO3��CuSO4��NaCl��CaCl2��NaOH�е�һ�ֻ��֣�Ϊȷ����ɷ֣�ij��ͬѧ����ʦ��ָ���½���̽����
��һ������̽����
��.��ȡ������Ʒ����������ˮ�г���ܽ⣬���˺�õ���ɫ��������ɫ��Һ����ʵ�������֪��ԭ������һ������____��
��.ȡ���еõ�����Һ���������ʵ�����̽��ԭ����ijɷ֣�����������ʵ�鱨�沢�ش����⡣
���� | ���� | ���� |
����Һ�м��������Ȼ�����Һ | ������ɫ���� | ԭ������һ������____ |
ȡ�ϲ���Һ���μ�____ | ____ | ԭ�����в���NaOH |
���У��������������Ȼ�����Һ��Ŀ�ij��˼���һ�����е������⣬������������____��
��.��ȡ���еõ�����Һ�������������²�����
![]()
ͬѧ����Ϊ��ԭ������һ������NaCl��������ʦָ��������۲���ȷ����������___������ţ�
A.��Һ�к���Na2CO3��Ҳ�ܺ�AgNO3��Ӧ���ɳ���
B.��Һ�е�NaCl��������ԭ�����е�Na2CO3��CaCl2��Ӧ����
����������̽����
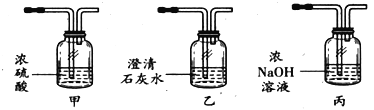
����ʦ��ָ����ͬѧ���־�ȷ������10gԭ���壬��������ʵ�飺
ͬѧ����Ϊ�����ݡ�����ȫ���ܽ⡱�������ȷ����ɫ�����ijɷ���____����ԭ������һ������____�����У�����X��������____����ɫ��Һ��һ�����е���������____��
�Ը������ɳ�������������ԭ�������Ȼ��Ƶ�����������д���������_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȼ��������̿�����ϣ���С�����ϼ���ˮ���ῴ���л����������ʲô������ȼ�գ�С����С����С����С÷��ɵĺ���ѧϰС��Դ�����չ����̽����
�����ڽ������γɹ�ʶ����������������ȼ�ղ���������Ȼ�л��磬ˮ����ȵ�̿��Ӧ�϶������˿�ȼ�����壬ͬʱӦ�û���δ��Ӧ��ˮ������
��������룩С�������ܺ���CO��С÷�����ܺ���H2��С����Ҳ������CO��H2�Ļ���С�������ų��в���ȼ���������ɣ����ܻ���������CO2��
���������ϣ���ˮ����ͭ��ˮ�ɰ�ɫ��Ϊ��ɫ��
�����ʵ�飩����ѧϰС���Ա���������ʵ��װ��ͼ����������ʵ�顣
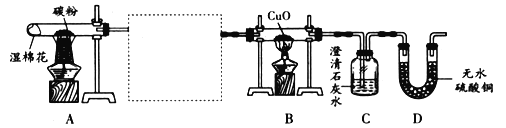
(1)�뽫�ס��ҡ���װ�ð�һ��˳�����Ӻ������ͼ�����У���ȷ������˳����_____
(2)��֪�Թ����������뷴Ӧ�����������Dz���ˮ������װ�ü�������_____��
(3)ʵ���й۲쵽װ���ҡ�C�г���ʯ��ˮ������ǣ�B�к�ɫ��ĩ��죬D����ˮ����ͭ�ɰ�ɫ��Ϊ��ɫ��д�����б仯�Ļ�ѧ����ʽ_____��
�����۽�����(4)С����Ϊ����������������˵��������������һ������H2��С÷��Ϊֻ�轫����װ�������Ľ����Ϳ�֤��������������һ������H2��С÷�ĸĽ���_____��
(5)С����Ϊ��ʵ�龭�����Ľ�������һ�����Ե�ȱ�ݣ���ȱ����_____��
��ʵ����ۣ����ȵ�̿��ˮ������Ӧ��H2��CO��CO2���ɡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������װ��ͼ���ش��й����⣺
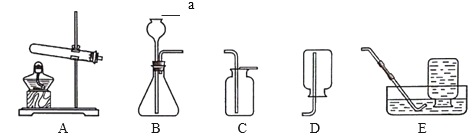
��1��д��װ��ͼ�б�����������ƣ�a____��
��2��ʵ�����ø��������ȡ�������䷢��װ�ÿ�ѡ��____������ĸ������Ӧ�Ļ�ѧ����ʽ��____������Eװ���ռ�������ԭ����____��
��3��ʵ����ͨ����װ��B��____������ĸ��������ȡ������̼���÷�Ӧ��ѧ����ʽ��____������ͼ��ʾװ���ƶ�����̼���С��濪���á������ͣ����Ч�����ڷ�Ӧ�Ĺ����У����رյ����ϵĻ���K����Ӧֹͣ����ԭ����____��
��4���ô����Ķ�����̼���尴��ͼװ�ý���ʵ�顣�۲쵽����Ҫ�����ǣ�����____�����г���ʯ��ˮ����ǡ����з�����Ӧ�Ļ�ѧ����ʽΪ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����ķ�ˮ�к���MgSO4��FeCl3��������Ա����NaOH��Һ���ڷ�ˮ��pH���Ⱥ��������ֳ�������ͨ��ϵ�д����õ��м�ֵ�IJ�Ʒ��

��֪��Mg��OH��2��Fe��OH��3��������ˮ�����Ȼᷢ���ֽ⡣���������̣��ش��������⣺
��1����������������_____��������ʱ��������_____����ֹͣ���ȡ�
��2������A��ij�ᷴӦ�Ļ�ѧ����ʽΪ_____��
��3������B���ȵõ�Fe2O3��Ӧǰ����Ԫ�ػ��ϼ۵ı仯�����_____������ߡ��������͡����䡱����
��4����Һa���˿��ܺ���NaOH�⣬��һ�����е�������_____���ѧʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ��������ij����������Һ��ȡ��������100g ����������Һ�м���5g �Ķ������̣���ַ�Ӧ���ˣ��õ���Һ97.2g����ԭ����������Һ����Ԫ�ص����������ǣ�������
A. 10.8%B. 35%C. 0.35%D. 5.9%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ����Ҫ�Ļ���ԭ�ϣ�Ҳ��ʵ�����г��õĻ�ѧ�Լ��������Ƕ���������ʡ���ȡ����;�ȷ����̽�������㹲ͬ���벢�ش��й����⡣
��̽��һ�����������
(1)̽��Ũ�����ijЩ���ԡ�
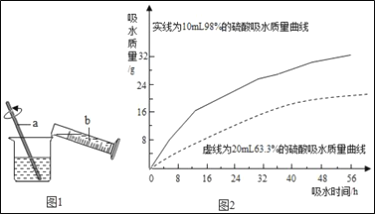
����Сľ��պȡ����Ũ���ᣬ����һ��ɹ۲쵽___��
��Ũ�����ϡ�ͣ�Ũ����ϡ������ͼ1��ʾ��b��ʢ�ŵ�������___��a��������___��
����ȤС���98%��Ũ����10ml��63.3%��������ҺԼ20mL�ֱ����������ͬ��С�ձ��У��������۲졢��¼���������������»�����ʵ������ݻ�ɵ�������ͼ2����ͼ2�������ܵõ���ʵ����ۣ�_____(д����)��
(2)̽��ϡ����Ļ�ѧ���ʡ�
��ͼ3��������ϡ����ֱ����A��E����ֻ�ձ��С�
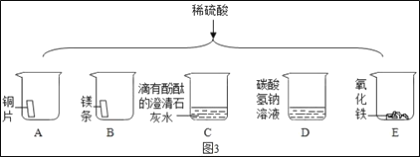
���в������ݵ���___(����ţ���ͬ)���а�ɫ�������ɵ���___��
����֤��C�з�����ѧ��Ӧ��������___��
(3)��д��ϡ�����һ����;___��
��̽����������Ĺ�ҵ�Ʒ���
��ҵ���Ի�����Ϊԭ����������Ĺ���������ͼ4��ʾ��
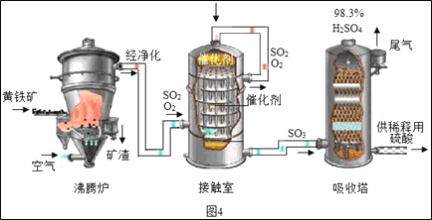
(1)�Ӵ����з����Ļ�ѧ����ʽΪ___��
(2)������������Ĺ�������ͼ������˵����ȷ����___(����ĸ���)��
A Ϊʹ��������ȼ�գ��轫����� B �����ܹ����SO2�ķ�Ӧ���ʺͲ���
C �������еõ��IJ�ƷΪ����� D ����¯�ų��Ŀ����ɹ�����
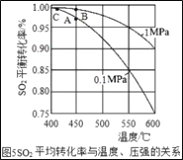
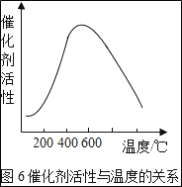
(3)�Ӵ����е�SO2ƽ��ת�������¶ȼ�ѹǿ�Ĺ�ϵ��ͼ5��ʾ�������������¶ȵĹ�ϵ��ͼ6����ʵ�������У�SO2��������Ӧ������ѡ��ѹ��450��(��Ӧͼ��A��)����û��ѡ��SO2ת���ʸ��ߵ�B��C���Ӧ�ķ�Ӧ��������ԭ��ֱ���___��___��
��̽������̽��ij��������FeS2�ĺ�����
ͬѧ�ǽ���������ʵ��̽����
���������ϣ���4FeS2 +11O2 ![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
��Na2SO3 +H2O2 ��Na2SO4 +H2O
��ʵ��̽����
���ȡ1.60g��������Ʒ������ͼ7��ʾװ��(�г�װ��ʡ��)��ʯӢ���У���a�����ϵػ���ͨ���������������ʯӢ���еĻ�������Ʒ����ȫ��Ӧ��
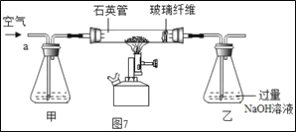
��Ӧ��������ƿ�е���Һ������ͼ8����
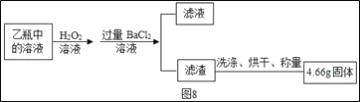
���������ۣ�
(1)I��װ�ü�ƿ��ʢ�ŵ��Լ�������������Һ����������___��II����Һ����������һ����___��
�������ⶨ��
(2)II�����յõ���4.66g������___(�ѧʽ)��
(3)����û�������FeS2����������Ϊ___��(д���������)
��������˼��
(4)���ȱ�ټ�װ�ã������ղ��FeS2��������������___(����ƫ������ƫС����������)
(5)���֤��II������BaCl2��Һ�ѹ���(���Ҫд����������������)___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ù������Ʒ�Ӧ����ȡ��������DZˮԱʹ�õĹ���װ�õ�ԭ����
���������ϣ����³�ѹ�¹��������ǵ���ɫ���壬�ڲ���Ҫ���ȵ���������������̼��Ӧ������������һ����������г������Σ���������������ˮ��Ӧ�����������������ơ�
�����װ�ã�Ϊ��֤�������ƣ�Na2O2����CO2��Ӧԭ�����������ʵ��װ�á�
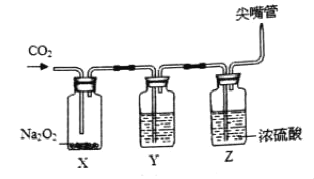
��ʵ���������װ�â���ͨ������CO2���壬�۲쵽Xƿ�еĵ���ɫ������Ϊ��ɫ��ĩ��ͬʱ����Y��Zװ���������ݳ��֡�
��ʵ�������
��1�����������������̼��Ӧ�����������⣬��һ������Ļ�ѧʽΪ_____�� Y�е���Һ������������Һ��Z��Ũ�����������_____��
��2����֤�������ƺͶ�����̼��Ӧ���������IJ�����_____��
��3����Ӧ���������һ����ʵ�飬��֤Xƿ�й��������Ƿ���ʣ�ࣨ���ö�����̼��֤�⣩����ʵ��ԭ����_____�����û�ѧ����ʽ��ʾ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com