
分析 (1)根据氢氧化钠的质量利用化学方程式求出废液中硫酸的质量即可;
(2)根据溶液溶质的质量分数=$\frac{溶质质量}{溶液质量}$×100%进行解答.
解答 解:
设废液中硫酸的质量为x,生成硫酸钠的质量为y.
2NaOH+H2SO4═Na2SO4+2H2O
80 98 142
2%×20g x y
$\frac{80}{2%×20g}=\frac{98}{x}=\frac{142}{y}$
x=0.49g
y=0.71g
恰好完全反应时,所得溶液溶质的质量分数=$\frac{30g-29.22g-0.49g+0.71g}{30g+20g}$×100%=2%
答:
(1)0.49
(2)恰好完全反应时,所得溶液溶质的质量分数2%.
点评 此题是对溶液进行的综合计算,涉及到溶质质量的计算、方程式的计算,解决此题对学生计算能力的提高有一定好处.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 溶液一定是无色透明的混合物 | |
| B. | 饱和溶液变为不饱和溶液,溶质质量分数一定变小 | |
| C. | 物质溶于水,溶液温度一定升高 | |
| D. | 溶液中析出晶体,溶质质量分数可能不变 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 原子呈电中性 | |
| B. | 原子核都是由质子和中子构成 | |
| C. | 原子由原子核与核外电子构成 | |
| D. | 原子可构成分子,有的也可直接构成物质 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
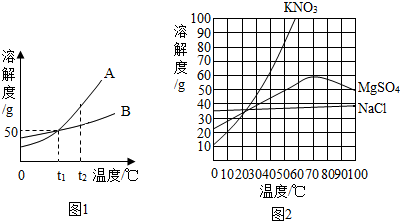
 图一为甲、乙两种物质(不带结晶水)的溶解度曲线图.
图一为甲、乙两种物质(不带结晶水)的溶解度曲线图.查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com