
(3分)为了测定某产品中碳酸钡的质量分数进行了如下实验。取一定量的样品和400g溶质质量分数为10%的稀盐酸放入烧杯中。在化学反应过程中对烧杯及其中的剩余物进行了五次称量,记录如下表:(假设反应匀速进行;杂质不溶于水,也不与稀盐酸反应,烧杯的质量为25.4g)
| 反应时间 | t1 | t2 | t3 | t4 | t5 |
| 烧杯和药品质量/g | 516.6 | 507.8 | m | 503.4 | 503.4 |
(1)503.4g(2)98.5%;(3)23.6%
解析试题分析:(1)由题中的叙述反应为匀速进行,故每个时间段减少的质量应该相等,t1到t2减少的质量为516.6-507.8= 8.8g,到t4时也没在减少8.8g,故在t3反应段碳酸钡就反应完,故剩余质量为503.4g
(2)生成的二氧化碳的总质量为:516.6g-507.8g=8.8g, 507.8g-503.4g=4.4g, 8.8g+8.8g+4.4g=22g
解:设碳酸钡的质量为x,消耗盐酸的质量为y,产生氯化钡的质量为z。
BaCO3 + 2HCl = BaCl2 + H2O + CO2↑
197 73 208 44
x y z 22g 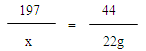
X=98.5g
503.4g+22g-25.4g-400g=100g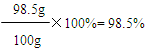
答:该产品中碳酸钡的质量分数为98.5%。
(3)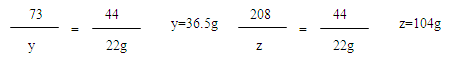
36.5g÷10%=365g
365g+98.5g-22g=441.5g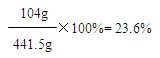
答:若产品中碳酸钡与稀盐酸恰好完全反应时,所得溶液中溶质的质量分数为23.6%。
考点:有关溶液的计算,化学方程式的计算


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:初中化学 来源: 题型:计算题
为检查某石灰石样品中碳酸钙的纯度,取该样品12g放入烧杯中,再向烧杯中加入35g稀盐酸,恰好完全反应(杂质不参加反应),反应后烧杯中剩余固体物质共42.6 g,
(1)反应生成CO2的质量为 g;
(2)石灰石样品中碳酸钙的质量分数(结果保留至0.1%)
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(3分)为测定石灰石样品中碳酸钙的含量,小明取25 g石灰石样品与一定质量的14.6%的稀盐酸恰好完全反应,将反应所得混合物蒸干得到固体27.2 g(不含结晶水,假设样品中的杂质既不与稀盐酸反应)。试计算:
(1)参加反应的盐酸的质量。
(2)石灰石样品中碳酸钙的含量。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(3分)取含Na2CO3和NaCl的样品34g放在烧杯中并加入稀盐酸146g,恰好完全反应,此时,烧杯内溶液的总质量为175.6g。
计算:反应后所得溶液的溶质质量分数。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
某兴趣小组同学在一次实验中偶然发现:向盛有一定量铁粉的烧杯中加入稀硫酸有气泡产生,迅速加入一定量的氧化铜,搅拌,不再产生气泡、黑色粉末中逐渐出现红色固体后又有气泡产生。请回答:
① 若实验过程中共收集到0.1 g氢气,求生成0.1 g氢气所消耗的硫酸的物质的量。
② 加入氧化铜后,不产生气泡的原因是 (11) (用化学方程式表示)。
③ 充分反应后过滤,为确定滤液中的溶质成分,在滤液样品中插入一根铁丝,可能出现的现象和结论如下。
| 现象 | 结论 |
| (12) | 滤液中的溶质是FeSO4 |
| 有红色固体析出 | 滤液中的溶质可能有哪几种情况? (13) |
| (14) | 滤液中的溶质是 (15) |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
鸡蛋壳的主要成分是碳酸钙,某兴趣小组为了测定鸡蛋壳中CaCO3的含量,现取15g鸡蛋壳,捣碎,放在烧杯中,然后向其中加入80g某浓度的稀盐酸,使之充分反应(鸡蛋壳中除CaCO3外的其他成分都不溶于水,且不与稀盐酸反应),测得烧杯中的反应剩余物的质量(m)与反应时间(t)的关系如图所示(忽略水蒸气的挥发),其中当反应进行到B点时,所用盐酸刚好消耗了加入量的一半,试计算(计算结果保留1位小数)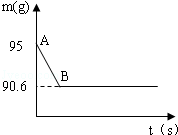
(1)产生CO2的质量为 g;
(2)该鸡蛋壳中CaCO3的质量分数;
(3)所用稀盐酸中溶质的质量分数;
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
我们的日常生活离不开食盐,食盐的主要成分是氯化钠,某同学想测定配制的氯化钠溶液的溶质质量分数。取100g氯化钠溶液,加入足量的硝酸银溶液,生成14.35g沉淀。试计算硝酸银溶液中溶质质量分数。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com