
对于重水D2O,在25℃时,KW=10-12,定义pD=-lgc(D+),则下列关于pD说法正确的是( )
A.25 ℃时,纯重水pD=7
B.25 ℃时,0.1 mol·L-1NaCl的重水溶液pD=pOD
C.25 ℃时,1 mol·L-1DCl的重水溶液pD=0,pOD=14
D.25 ℃时,0.1 mol·L-1NaOD的溶液中pD=10
科目:初中化学 来源: 题型:
一包含杂质的Na2CO3,其杂质可能是Ba(NO3)2、KCl、NaHCO3,今取10.6g样品,溶于水得澄清溶液;另取10.6g样品,加入足量的盐酸,收集到4gCO2,则下列判断正确的是
A.样品中只含有NaHCO3 B.样品中一定混有NaHCO3,可能有KCl
C.样品中有NaHCO3,也有Ba(NO3)2 D.样品中混有KCl,也可能有NaHCO3
查看答案和解析>>
科目:初中化学 来源: 题型:
福建省博物馆最近启用新购置的“真空充氮杀虫灭菌消毒机”来处理和保护文物,即将文
物置于该机器内,三天后氮气浓度可达99.99%; 再密闭三天左右,好氧菌、厌氧菌和丝状霉菌都被杀灭。下列有关氮气的说法错误的是
再密闭三天左右,好氧菌、厌氧菌和丝状霉菌都被杀灭。下列有关氮气的说法错误的是
A.氮气是金属单质 B.高浓度氮气可抑制菌类的生长
C.通常情况下氮气的化学性质不活泼 D.氮气不能供给呼吸
查看答案和解析>>
科目:初中化学 来源: 题型:
等体积等物质的量浓度的MOH强碱溶液和HA弱酸溶液混合后,混合溶液中有关离子浓度关系正确的是( )
A.c(M+)>c(OH-)>c(A-)>c(H+)
B.c(M+)>c(A-)>c(H+)>c(OH-)
C.c(M+)>c(A-)>c(OH-)>c(H+)
D.c(M+)+c(H+)>c(A-)+c(OH-)
查看答案和解析>>
科目:初中化学 来源: 题型:
常温下,pH=12的一元弱碱和pH=1的一元强酸等体积混合后(不考虑混合后溶液体积的变化),恰好完全反应,则下列说法正确的是( )
A.反应后的溶液呈酸性
B.弱碱的浓度小于强酸的浓度
C.弱碱中OH-的浓度为0.1 mol·L-1
D.弱碱的浓度大于强酸的浓度
查看答案和解析>>
科目:初中化学 来源: 题型:
(1)体积相同,浓度均为0.2 mol·L-1的盐酸和CH3COOH溶液,分别加水稀释10倍,溶液的pH分别变成m和n,则m与n的关系为________。
(2)体积相同,浓度均为0.2 mol·L-1的盐酸和CH3COOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成3,则m与n的关系为________。
(3)体积相同,pH均等于1的盐酸和CH3COOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成3,则m与n的关系为________。
(4)体积相同,pH均等于13的氨水和NaOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成9,则m与n的关系为________。
查看答案和解析>>
科目:初中化学 来源: 题型:
近来科学家研制了一种新型的乙醇电池(DEFC),它用磺酸类质子作溶剂,在200℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更加安全。电池总反应式为C2H5OH+3O2===2CO2+3H2O,下列说法不正确的是( )
A.C2H5OH在电池的负极上参加反应
B.1 mol乙醇被氧化转移6 mol电子
C.在外电路中电子由负极沿导线流向正极
D.电池正极的电极反应为 4H++O2+4e-===2H2O
查看答案和解析>>
科目:初中化学 来源: 题型:
用下图装置进行电解实验(a、b、c、d均为铂电极),供选择的有4组电解液,要满足下列要求:
| 组 | A槽 | B槽 |
| 1 | NaOH | CuSO4 |
| 2 | AgNO3 | CuCl2 |
| 3 | Na2SO4 | AgNO3 |
| 4 | NaCl | AgNO3 |
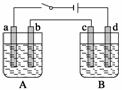
①工作一段时间后,A槽pH上升,B槽的pH下降;
②b、c两极上反应的离子的物质的量相等。
(1)应选择的电解质是上述四组中的第____组。
(2)该组电解过程中各电极上的电极反应为
a极: ________________________________________________________________,
b极: ________________________________________________________________,
c极: ________________________________________________________________,
d极: ________________________________________________________________。
(3)当b极上析出7.1 g电解产物时,a极上析出产物的质量为________ g;若B槽电解质溶液为500 mL,且忽略电解前后电解液的体积变化,则此时B槽中的c(H+)比电解前增加了
________ mol·L-1。
查看答案和解析>>
科目:初中化学 来源: 题型:
一定条件下,在体积为3 L的密闭容器中化学反应CO(g)+2H2(g)CH3OH(g)达到平衡状态。
(1)该反应的平衡常数表达式K=________;根据下图,升高温度,K值将______(填“增大”、“减小”或“不变”)。
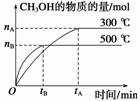
(2)500 ℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是__________(用nB,tB表示)。
(3)判断该可逆反应达到化学平衡状态的标志是______(填字母)。
a.v生成(CH3OH)=v消耗(CO)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d.CO、H2、CH3OH的浓度均不再变化
(4)300 ℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是____(填字母)。
a.c(H2)减小
b.正反应速率加快,逆反应速率减慢
c.CH3OH的物质的量增加
d.重新平衡时c(H2)/c(CH3OH)减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com