
有一包粉末,可能是氯化钾、碳酸钠、三氯化铁、硫酸钠、硝酸钡中的一种或几种组成.为了研究它的组成,我做了如下实验,现将研究的问题和实验过程填写在表中(假设各步恰好完全反应):
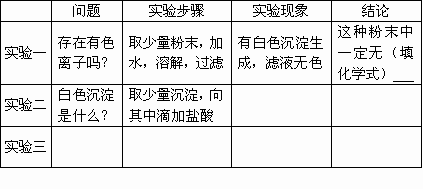
通过实验推断此粉末的组成是________.
|
【过程探究】首先要清楚,这五种物质的组成,颜色、状态、溶解性,以及它们在溶液中可能发生的反应. 题中给出的五种物质均属于盐类,盐是由金属离子和酸根组成的:
由实验一推断,溶液中不存在有色的离子,这种粉末中一定无FeCl3;白色沉淀可能是BaSO4、BaCO3中的一种或两者的混合物. 在实验二中,如果沉淀完全消失,并有无色气体生成,则白色沉淀是BaCO3,这种粉末中一定含有Na2CO3和Ba(NO3)2;如果沉淀不消失,则白色沉淀是BaSO4,这种粉末中一定含有Na2SO4和Ba(NO3)2;如果沉淀消失一部分,并有无色气体生成,则白色沉淀是BaSO4和BaCO3的混合物,这种粉末中一定含有Na2SO4、Na2CO3和Ba(NO3)2. 实验三的目的是:确定这种粉末中有没有KCl.
所以,通过实验推断此粉末的组成是:一定含有硝酸钡,最少含有碳酸钠和硫酸钠中的一种,可能含有氯化钾,一定不含三氯化铁. |
|
【设计意图】本题主要检测:①实验探究的步骤和方法,②提出问题、设计实验并完成实验、记录实验现象和分析实验现象得出结论的能力,③运用酸、碱、盐知识解决实际问题的综合能力. |


科目:初中化学 来源: 题型:解答题
| 烧杯中可能出现的现象 | 结论 |
| ①杯中有黑色不溶物,上层清液为无色 | 粉末中只含________ |
| ②________ | 粉末中含C、CuO |
| ③________ | 粉末中含C、Fe |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 假设 | 设计的相关实验操作 | 实验中观察到的现象 | 假设是否成立 |
| ① | 取一定量粉末加入稀盐酸 | 没有气体产生 | ______ |
| ② | 取一定量粉末溶于水 | 溶液浑浊且温度升高 | ______ |
| ③ | 取一定粉末溶于水,静置后取上层清液再加入氢氧 化钡溶液 | 没有沉淀产生 | ______ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 操 作 | 现 象 | 结 论 |
| 实验①:取少量粉末,加水溶解 | 得到无色透明溶液 | 原粉末中一定没有______ |
| 实验②:取①所得溶液少许,加入氢氧化钠溶液 | 看不到明显现象 | 原粉末中一定没有______ |
| 实验③:取①所得溶液少许,加入适量硝酸钡溶液 | 出现白色沉淀 | 原粉末中一定有______中的一种或两种 |
| 实验④:将实验③所得混合物过滤后,在沉淀中加入稀硝酸 | ______ | 原粉末中一定有K2SO4、K2CO3两种物质 |
| 操 作 | 现 象 | 结 论 |
| ______ | ______ | ______ |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
过氧化钠(Na2O2)是一种淡黄色固体。在一次科技活动中,同学们将包有Na2O2固体的棉花放入了如右图所示的装置中,发现高低不同的两根蜡烛,下面的蜡烛先熄灭,上面的蜡烛后熄灭,同时也惊奇地发现棉花燃烧了起来。
(1)实验过程中蜡烛由下往上依次熄灭,说明二氧化碳
具有 的性质。
(2)棉花为什么会燃烧呢?同学们认为棉花要燃烧,除了满足棉花是可燃物之外,还需
满足 、  。
。
【提出问题】上述实验中是如何给棉花提供燃烧条件的?
【查阅资料】1.在常温下Na2O2与CO2、H2O均能发生化学反应。
2.无水硫酸铜为白色固体,吸水后变为蓝色。
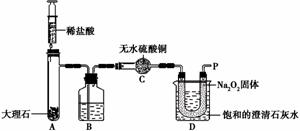
【实验设计】经过讨论,同学们设计用下图所示装置进行实验探究。
 | |||
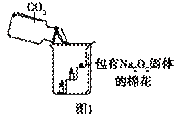 | |||
【实验步骤】①检查整套装置的气密性; ②把相关的试剂放入对应的仪器内;
③用力推动针筒的活塞,把稀盐酸注入试管内;
④一段时间后,在P处放 置一根带火星的木条,观察现
置一根带火星的木条,观察现 象。
象。
注意:大理石与稀盐酸制取的CO2还会含有一定量的水蒸气,但整个实验过程中不考虑稀盐酸的挥发和空气对实验的影响。
【实验现象】
①带火星的木条复燃; ②无水硫酸铜没有变蓝色; ③饱和的澄清石灰水变浑浊。
【实验分析】①B装置内盛放的试剂是 ;②D装置烧杯内澄清石灰水变浑浊的原因可能是 ,也可能是空气中的CO2与澄清石灰水反应生成了难溶物使澄清石灰水变混浊。
【实 验结论】
验结论】 ①Na2O2和CO2反应产生的一种气体,使图1中的棉花满足了燃烧的一个条件。
①Na2O2和CO2反应产生的一种气体,使图1中的棉花满足了燃烧的一个条件。
②Na2O2和CO2反应过程中伴随能量变化,使图1中的棉花满足了燃烧的另一个条件。
【拓展提高】①Na2O2和CO2反应除生成一种气体外,还生成了一种固体,学生甲认为生成的固体是NaOH,学生乙认为是Na2CO3,同学们经思考后认为甲同学的猜想是错误的,理由是 。
②写出Na2O2和CO2反应的化学方程式  。
。
【定量探究】有一包久置的过氧化钠粉末,现已证明因其保存不当导致完全变质成为NaOH和Na2CO3的混合物,同学们称取了13.25g样品,加入足量稀盐酸,并将产生的气体通入足量的澄清石灰水中,得到白色沉淀,经过滤、洗涤、烘干后称得其质量为10g,试计算:样品中Na2CO3的质量分数。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com