
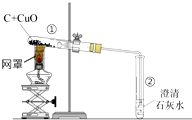
 用木炭还原氧化铜的实验如图.
用木炭还原氧化铜的实验如图.分析 (1)根据酒精灯的使用进行分析;
(2)根据气体的体积与温度的关系进行分析;
(3)根据木碳还原氧化铜的反应进行分析
(4)根据热的铜能与氧气反应分析回答.
解答 解:(1)酒精灯加灯罩可以集中火焰,提高温度;
(2)试管内有空气,加热时空气体积膨胀,开始排出的是试管内的空气;
(3)在高温条件下,木碳还原氧化铜生成了铜和二氧化碳,反应的化学方程式是:C+2CuO$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑;
(4)由于热的铜能与氧气反应生成了氧化铜,所以停止加热时,应先将导管从试管②中撤出,并用弹簧夹夹紧橡皮管,待试管①冷却后再把试管里的粉末倒出.这样操作的原因是:防止灼热的铜被氧化.
故答为:(1)提高酒精灯火焰的温度;(2)开始排出的是试管内的空气;(3)C+2CuO$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑;(4)防止灼热的铜被氧化.
点评 本题主要考查了碳还原氧化铜的实验现象和实验操作,解题时根据所给的实验、问题情景等,结合所学的相关知识和技能,特别是有关的实验现象、操作步骤及其注意事项等,细致地阅读、分析题意,细心地进行探究、推理,最后,按照题目的要求,认真地进行选择或解答即可.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:选择题
 在2014年全国两会召开时“实名制”矿泉水亮相,服务员们“沏茶倒水”的场景不再出现,取而代之的是为每名委员提供一瓶矿泉水,而且每瓶矿泉水上还贴有委员名字.下面相关说法不正确的是( )
在2014年全国两会召开时“实名制”矿泉水亮相,服务员们“沏茶倒水”的场景不再出现,取而代之的是为每名委员提供一瓶矿泉水,而且每瓶矿泉水上还贴有委员名字.下面相关说法不正确的是( )| A. | 矿泉水属于溶液 | |
| B. | 水是人体六大类营养物质之一 | |
| C. | 矿泉水中的矿物质钙、锌、铁、硒都属于人体需要的微量元素 | |
| D. | 灌装矿泉水的塑料瓶子可以回收 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 选项 | 物质 | 杂质 | 试剂、方法 |
| A | CO2 | CO | 将气体点燃 |
| B | MnO2 | 炭粉 | 在空气中灼烧 |
| C | KCl | BaCl2 | 加入适量的Na2SO4溶液,过滤 |
| D | FeSO4溶液 | CuSO4 | 加入足量铁屑,充分反应后过滤 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | +3 | B. | +6 | C. | +7 | D. | +9 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com