
分析 在金属活动性顺序中,位于氢前面的金属能置换出酸中的氢,位于前面的金属能把排在它后面的金属从其盐溶液中置换出来,据此判断能否发生反应,进而可确定三种金属活动性由强到弱的顺序.验证三种金属活动性强弱时,通常采取“三取中”的方法,即取中间金属单质与两端的金属的盐溶液反应或取中间金属的盐溶液与两端金属的单质反应.
解答 解:根据金属活动顺序,Al>H>Cu>Ag.这是进行分析的基础.下面设计的实验的分析就要结合这个结论来进行.
1、取中间的金属对应的可溶性的盐溶液,其余两种都用单质,铝片、硫酸铜溶液、银丝:Al和CuSO4反应,则Al>Cu;而Ag和CuSO4不反应,则Cu>Ag.所以可以得出Fe>Cu>Ag.故用2支试管各取少量硫酸铜溶液,分别插入铝片、银丝,铁丝表面覆盖一层红色铜,银丝表面无变化;
2、取中间的金属的单质,另外两种取对应盐溶液.铜片、硫酸铝溶液、硝酸银溶液.可以进行的实验时将铜片分别插入(或加入)到硫酸铝溶液和AgNO3溶液,铜片遇到硫酸铝溶液无明显现象,得出Fe>Cu;遇到AgNO3溶液表面变成白色,溶液也变成蓝色,得出Cu>Ag.所以得出Fe>Cu>Ag.
3、铝片、铜片、AgNO3溶液、稀盐酸:铝片和稀盐酸反应,得出Al>H.而Cu和Ag均不能与稀盐酸反应,所以Fe>Cu,Fe>Ag.Cu和AgNO3溶液反应,则Cu>Ag.所以可以得出:Fe>Cu>Ag.故用3支试管各取少量HCl,分别插入铁丝、铜丝、银丝,取少量AgNO3溶液,插入铜丝;铁丝表面有气泡产生,铜丝、银丝表面无变化,铜丝表面覆盖一层银白色金属.(合理即可)
故答案为:②③⑥;①⑤⑦;①③④⑤.(合理即可)
点评 金属活动的探究实验,可以设计不同的方案,而并非每一个方案都能形成相应结论,这就要求我们认真分析每一个方案,最终选择出合理方案付诸实施.分析时要从已经掌握的金属活动顺序来分析,判断反应是否发生,然后从反应的是否反应以及反应的快慢形成结论,最后归纳出所探究所有金属之间的关系.


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
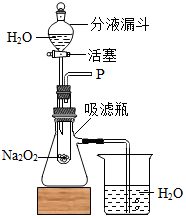 在学校的元旦联欢会上,某同学表演了“水能生火”的魔术.他向包有过氧化钠(Na2O2)粉末的脱脂棉上滴水,脱脂棉燃烧起来.小蔡很感兴趣,于是,他和同学们进行探究.
在学校的元旦联欢会上,某同学表演了“水能生火”的魔术.他向包有过氧化钠(Na2O2)粉末的脱脂棉上滴水,脱脂棉燃烧起来.小蔡很感兴趣,于是,他和同学们进行探究.| 实验步骤 | 实验现象 | 实验结论 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 某同学用如图装置测定空气中氧气的体积分数.请你填写有关空格.
某同学用如图装置测定空气中氧气的体积分数.请你填写有关空格.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
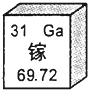 目前世界上最大直径的单洞双层公路隧道--瘦西湖隧道于9月19日正式建成通车.隧道中采用的光源是今年获得诺贝尔奖的蓝光“LED”,氮化镓(GaN)是制作这种“LED”节能光源的主要材料,镓元素的相关信息如图.下列有关镓的说法错误的是( )
目前世界上最大直径的单洞双层公路隧道--瘦西湖隧道于9月19日正式建成通车.隧道中采用的光源是今年获得诺贝尔奖的蓝光“LED”,氮化镓(GaN)是制作这种“LED”节能光源的主要材料,镓元素的相关信息如图.下列有关镓的说法错误的是( )| A. | 原子的核电荷数是31 | B. | 元素符号是Ga | ||
| C. | 属于金属元素 | D. | 相对原子质量为69.72g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com