
【题目】化学与药品研发
2015年,屠呦呦因发现青蒿素并成功研制出抗疟新药,成为我国本土第一位诺贝尔生理学或医学奖得主。我国的许多医学著作中都有使用青蒿治疗疟疾的记载。屠呦呦团队通过研究,发现了青蒿素,确定了它的组成、结构,并成功合成。
(1)提取过程
研究人员先是采用水煎法(将青蒿放入水中,加热煮沸、浓缩),发现得到的提取物对疟原虫无抑制效果;而采用95%的乙醇(乙醇沸点78℃)为溶剂进行提取,得到的提取 物有效率为 30%~40%;后来又采用乙醚(沸点35℃)为溶剂,得到的提取物有效率达到95%以上。课题组将提取物中的有效成分命名为青蒿素。
根据青蒿素的提取过程推测青蒿素的物理性质和化学性质 (各写一条)
和 等。
(2)结构分析
确定中草药成分的化学结构是药物研制过程中十分重要的一环。在成功分离出青蒿素晶体后,课题组立即着手分析其化学结构。
①定性分析
取适量青蒿素,在氧气中充分燃烧,测得生成物只有二氧化碳和水,由此推断青蒿素中一定合有的元素是(用符号表示) 。
②定量分析
实验测得青蒿素的相对分子质量是282,其中碳元素的质量分数是63.8%,氢元素的质量分数是7.8%,根据以上信息,写出确定一个青蒿素分子中氧原子个数的计算式(只列 式,不 计算结果) 。
③主要抗疟结构分析
青蒿素对疟原虫有很好的抑制作用,可能是因为它有较强的氧化性,青蒿素分子中具有怎样的结构才使它有较强的氧化性呢?
我们熟悉的过氧化氢溶液有较强的氧化性,医疗上常用它杀菌消毒,过氧化氢分子中原子间相互结合的方式有“H-0-、-0-0-”两种,青蒿素分子中原子间相互结合的方式有“![]() ”等几种。你认为青蒿素分子中起杀菌作用的原子间相互结合的方式是 。
”等几种。你认为青蒿素分子中起杀菌作用的原子间相互结合的方式是 。
以上是运用已有知识进行的推理,推理是否正确,需要通过 进行验证。
(3)化学合成
青蒿中青蒿素的含量只有0.1%~1%,课题组于1984年成功合成了青蒿素。请你谈一谈化学合成青蒿素有哪些优点 (答一点即可) 。
【答案】(1)不溶于水(或能溶于乙醇或易溶于乙醚或能溶于有机溶剂),受热不稳定(或受热易变质或受热易分解或热稳定性差或能杀菌或能抑制疟原虫)
(2)

(3)产量高(或可以规模生产或减少占地耕地或不受季节限制 )
【解析】
试题分析:(1)根据青蒿的提取过程分析,青蒿素的物理性质:不溶于水(或能溶于乙醇或易溶于乙醚或能溶于有机溶剂),青蒿素的化学性质:受热不稳定(或受热易变质或受热易分解或热稳定性差或能杀菌或能抑制疟原虫)
(2)①根据质量守恒定律:化学反应前后,元素的种类不变,故结合青蒿素在氧气中充分燃烧,测得生成物只有二氧化碳和水,由此推断青蒿素中一定合有的元素是C、H
②根据相对分子质量的计算方法,一个青蒿素分子中氧原子个数的计算式=282×(1-63.8%-7.8%)/16
③根据过氧化氢溶液有较强的氧化性,医疗上常用它杀菌消毒,而具有氧化性的原子是氧原子,故可青蒿素分子中起杀菌作用的原子间相互结合的方式是-O-O-;以上是运用已有知识进行的推理,推理是否正确,需要通过实验进行验证
(3)根据信息:青蒿中青蒿素的含量只有0.1%~1%,课题组于1984年成功合成了青蒿素,故化学合成青蒿素的优点:产量高(或可以规模生产或减少占地耕地或不受季节限制 )


科目:初中化学 来源: 题型:
【题目】实验是科学探究的重要途径,请根据如图装置回答有关问题:
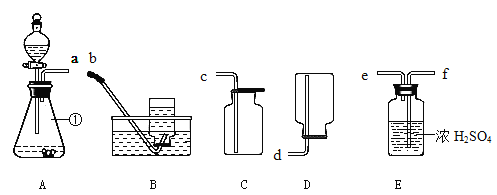
(1)写出有标号仪器的名称:①______________。
(2)E中的浓硫酸具有吸水性,可用来干燥某些气体。在化学实验中常用到稀硫酸,稀释浓硫酸的正确方法是____________________________________。
(3)若用上述A装置制取二氧化碳,则发生反应的化学方程式为____________________,若要制取和收集一瓶干燥的二氧化碳气体,其装置接口的连接顺序是![]() (用接口字母顺序从左至右连接)
(用接口字母顺序从左至右连接)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】元素观是化学的重要观念之一,下列有关元素的说法错误的是
A.物质都是由元素组成的
B.同种元素的原子核内中子数相同
C.在化学变化中元素的种类不发生改变
D.元素周期表中原子序数等于该元素原子核内的质子数
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】向盛有一定质量稀硫酸的烧杯中逐渐加入10g锌粒,产生气体质量与锌粒质量的关系如图所示;充分反应后,称得烧杯中剩余物质总质量为109.8g。请根据关系图分析并计算:
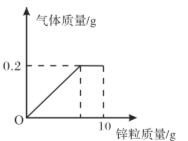
(1)稀硫酸反应完时,产生氢气的质量为 g,消耗锌粒质量为 g。
(2)该稀硫酸中溶质的质量分数(写出计算过程)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】探究影响化学反应速率的因素
(1)发现和提出问题
镁在空气中能够剧烈燃烧,铁丝在氧气中能够剧烈燃烧,而真金不怕火炼,这说明决定物质之间能否发生反应以及反应速率的内因是 。
蜡烛在氧气中燃烧比在空气中燃烧剧烈,这一事例中影响化学反应速率的因素是 ;夏天,将食品放在冰箱里不容易变质,这一事例说明温度也能影响化学反应速率。温度如何影响反应速率呢?
(2)猜想与假设
温度越高,反应速率越快。
(3)收集证据
实验药品:颗粒大小相同的锌粒;两份相同溶质质量分数、不同温度的稀硫酸(20℃、40℃)。
供选仪器:药匙、气体发生装置2套(气密性良好)、量筒2支、分液漏斗、秒表、胶头滴管、水槽、大试管2支。
利用上述仪器种药品,补充完成下表的实验报告。

该实验可以观察或测量的量有多种,除了上述观测点外,可以观察或测量的量还有(写一条)
等。
(4)结论与解释
从微观的角度分析“温度越高,应速率越快”的原因是 。
(5)拓展分析
根据其他测定方法,实验小组的同学绘制了锌粒与稀硫酸反应产生氢气的速率随时间变化的曲线,如图所示。请据图分析:
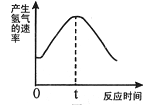
时间0—t内,反应速率逐渐加快的主要原因是 ,
时间t以后,反应速率逐渐减慢的主要原因是 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】取氯酸钾和二氧化锰的混合物13g,加热至混合物固体质量不再减少为止,冷却后称得剩余固体质量为8.2g,将剩余固体加入一定量的水中,充分搅拌后过滤,滤液是10%的氯化钾溶液(假设溶液无损失)。计算:
(1)生成氧气的质量。
(2)参加反应的氯酸钾的质量。(写出计算过程)
(3)氯化钾溶液的质量。(写出计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某兴趣小组为了研究露置于空气中的纯净生石灰(CaO)变质情况,进行了如下实验:
①称取生石灰25克,将其露置于空气中。
②一段时间后,称量发现质量增加了4克。
③将变质的“生石灰”溶于足量的稀盐酸,产生的气体全部通过足量的浓硫酸后,再通入足量的氢氧化钠溶液中,充分反应后称得氢氧化钠溶液的质量增加2.2克。
回答下列问题:
(1)变质的“生石灰”与稀盐酸反应生成二氧化碳的质量为 克。
(2)组成变质的“生石灰”各成分质量为多少?
(3)生石灰露置于空气中质量增加的原因是 ,故实验室中的生石灰应 保存。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】生活中常常会发生一些变化,下列变化属于化学变化的是( )
A.樟脑球在衣柜中渐渐消失 B.吃进的食物一段时间后被消化了
C.给电熨斗通电产生热能 D.在晾干的咸菜表面出现白色晶体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com