
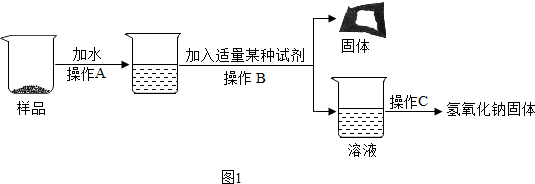
分析 (1)根据氢氧化钠和二氧化碳反应生成碳酸钠和水,碳酸钠和氢氧化钙反应会生成碳酸钙沉淀和氢氧化钠进行分析;
(2)根据过滤可以将不溶性固体从溶液中分离出来进行分析;
(3)根据要测定该固体中NaOH的纯度,需要用托盘天平来称量样品和沉淀的质量进行分析;
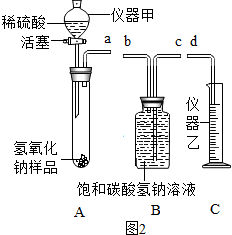
(4)根据碳酸氢钠溶液不吸收二氧化碳,二氧化碳密度比液体密度小进行分析;
(5)根据实验室常用仪器的名称,以及长颈漏斗的作用进行分析;
(6)根据二氧化碳的质量和化学方程式进行计算;
(7)根据盐酸具有挥发性进行分析.
解答 解:(1)氢氧化钠和二氧化碳反应生成碳酸钠和水,化学方程式为:2NaOH+CO2═Na2CO3+H2O,碳酸钠和氢氧化钙反应会生成碳酸钙沉淀和氢氧化钠,所以操作B中加入的试剂是Ca(OH)2;
(2)过滤可以将不溶性固体从溶液中分离出来,所以操作B的名称为:过滤;
(3)要测定该固体中NaOH的纯度,需要用托盘天平来称量样品和沉淀的质量,所以实验过程中一定还需用到的仪器是:托盘天平;
(4)碳酸氢钠溶液不吸收二氧化碳,二氧化碳密度比液体密度小,所以装置管口连接顺序为:a→b→c→d;
(5)通过分析题中所指仪器的作用可知,甲的名称是分液漏斗,使用该仪器有两个优点:一是可以控制稀硫酸的加入,二是节约药品;
(6)设碳酸钠的质量为x
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
106 44
x 0.11g
$\frac{106}{x}$=$\frac{44}{0.11g}$
x=0.265g
原样品中NaOH的纯度=$\frac{10g-0.265g}{10g}$×100%≈97.35%
答:原样品中NaOH的纯度是97.35%;
(7)盐酸具有挥发性,所以不能用盐酸代替硫酸.
故答案为:(1)2NaOH+CO2═Na2CO3+H2O,Ca(OH)2;
(2)过滤;
(3)托盘天平;
(4)b,c;
(5)分液漏斗,是节约药品;
(6)原样品中NaOH的纯度是97.35%;
(7)不同意,盐酸具有挥发性.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 水是人类宝贵的自然资源.
水是人类宝贵的自然资源.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验步骤 | 实验现象 | 实验结论 |
| 取滤液于试管中,逐渐滴加稀硫酸 | 产生白色沉淀 | 猜想正确 |
| 实验步骤 | 实验现象 | 实验结论 |
| 取滤液于试管中滴加少量的氢氧化钠溶液 | 产生蓝色沉淀 | 猜想正确 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

| 实验操作 | 现象 | 结论 | |
| 甲 | 取少量固体C,溶于适量水形成溶液后,滴加几滴酚酞试液 | 溶液变红 | 猜想成立 |
| 乙 | 取少量固体C,溶于适量水形成溶液后,滴加足量 稀盐酸 | 无气泡产生 | 猜想不成立 |
| 丙 | 取少量固体C,溶于适量水形成溶液后,滴加几滴饱和的M溶液 | 出现白色沉淀 | 猜想成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 物质 | CO2 | O2 | H2O | W |
| 反应前的质量(g) | 2 | 98 | 5 | 51 |
| 反应后的质量(g) | X | 2 | 59 | 5 |
| A. | 该反应是化合反应 | |
| B. | X的值是88 | |
| C. | W是一种由碳、氢、氧三种元素组成的化合物 | |
| D. | W是一种只由碳、氢两种元素组成的化合物 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com