
【题目】甲,乙两位同学在学习甲烷性质时,发现甲烷与氢气和一氧化碳性质上有很多相似之处,如密度比空气小,难溶于水,具有可燃性等。H2和CO具有还原性,那么甲烷有没有还原性呢?为了验证甲烷是否具有还原性,乙同学设计如图所示装置并进行实验:
[实验装置]
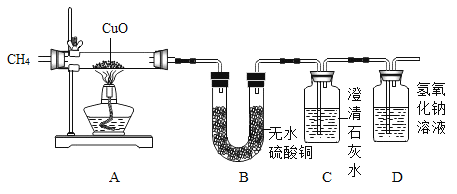
[实验步骤](假设药品都是足量的)
①分别称量装置A,B,C的质量;
②再次分别称量装置A,B,C的质量;
③向玻璃管中装入CuO,通入一段时间的CH4;
④停止加热,继续通入CH4至冷却到室温;
⑤缓缓通入足量的CH4,加热装置A,使其充分反应。
其合理的操作顺序是_____(填序号)。甲同学认为还缺少一个步骤,缺少的步骤是_____。
[进行实验]乙同学按照正确的步骤进行实验,并记录了实验现象和数据:
装置A中的黑色粉末变红;装置B中白色粉末变蓝;装置C中石灰水变浑浊;称量数据如表所示。
A中玻璃管(含药品)质量 | 装置B的质量 | 装置C的质量 | |
反应前 | 150 g | 156.6 g | 256.8 g |
反应后 | 147.2 g | 158.4 g | 257.9 g |
[现象分析与数据处理]
根据装置A,B,C中的现象可推知,CH4与CuO充分反应后的产物依次是_____。
[实验结论]
(1)CH4 _____(填“有”或“没有”)还原性;
(2)根据实验数据,甲同学提出甲烷与氧化铜反应的产物中还含有_____;
(3)装置A中发生的反应化学方程式为_____。
【答案】①③⑤④② 检查装置的气密性 Cu、H2O、CO2 有 CO ![]()
【解析】
[实验步骤]
按照如图所示的装置连接仪器后,后需要检查装置的气密性,防止装置漏气从而干扰实验。根据实验需要通过质量的改变得出结论,因此需要先分别称量装置A,B,C的质量。向玻璃管中装入CuO,通一段时间的CH4,以排净装置内的空气,防止加热时发生爆炸。然后缓缓通入足量的CH4,加热装置A,使其充分反应。等反应完再停止加热,继续通入CH4至冷却到室温,防止铜重新被氧化。最后再次分别称量装置A,B,C的质量,通过数据的变化进行计算。所以顺序为①③⑤④②。故答案为:①③⑤④②、检查装置的气密性;
[现象分析与数据处理]
装置A中的黑色粉末变红,证明生成了铜。装置B中白色粉末变蓝,证明生成了水。装置C中石灰水变浑浊,证明生成了二氧化碳。则可以推测出充分反应后的产物依次是Cu、H2O、CO2。故答案为:Cu、H2O、CO2;
[实验结论]
(1)通入甲烷后,氧化铜被还原为铜单质,则可以证明出甲烷、一氧化碳、氢气都具有还原性。故答案为:有;
(2)根据质量守恒定律可知,生成二氧化碳中碳元素的质量为:(257.9g-256.8g)×![]() =0.3g。生成的水中氢元素的质量为:(158.4g-156.6g)×
=0.3g。生成的水中氢元素的质量为:(158.4g-156.6g)×![]() =0.2g。则碳、氢元素的质量比为:0.3g:0.2g=3:2。而甲烷中,C:H=4:1,因此可知,还生成了一氧化碳。故答案为:CO;
=0.2g。则碳、氢元素的质量比为:0.3g:0.2g=3:2。而甲烷中,C:H=4:1,因此可知,还生成了一氧化碳。故答案为:CO;
(3)通过实验及计算可知,甲烷和氧化铜加热生成了铜、水、二氧化碳和一氧化碳,所以反应的方程式为:![]() 。
。


科目:初中化学 来源: 题型:
【题目】2018年10月,中科院大连化物所与福州大学化学学院合作发展了一种固态Z一机制复合光催化剂,实现了太阳能人工光合成燃料过程,反应的微观示意图如图所示:
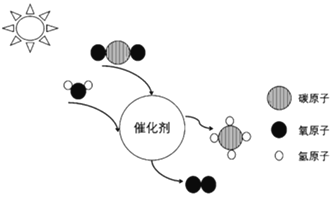
(1)该转化过程中,______(填“原子”或“分子”)没有发生变化,化合价升高的元素是______。
(2)写出该过程的化学方程式______。
(3)两种反应物的质量比为______。
(4)该过程可缓解______,是人类解决环境问题的途径之一。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙两物质的溶解度曲线如图所示。下列叙述中,正确的是( )
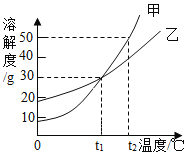
A. t1℃时,甲和乙溶解度均为30g
B. t2℃时,甲和乙的饱和溶液中溶质质量分数相等
C. t2℃时,在100g水中放入60g甲,其溶质的质量分数为37.5%
D. t2℃时,分别在100g水中各溶解20g甲、乙,同时降低温度,甲先达到饱和
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化工厂为综合利用生产过程中的副产品CaSO4,与相邻的化肥厂联合设计了制备(NH4)2SO4的工艺流程.
(工艺流程及原理)
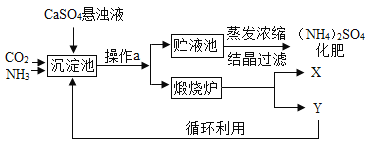
沉淀池中发生的主要化学反应为:CO2+2NH3+CaSO4+H2O=CaCO3↓+(NH4)2SO4
(讨论交流)
(1)操作a的名称是______,若在实验室进行此操作,用到的玻璃仪器除玻璃棒、烧杯外,还需要______。
(2)经操作a后得到的固体物质在煅烧炉中高温分解生成X和Y两种物质,该工艺中,Y被作为原料之一循环利用.Y的化学式为______。
(3)沉淀池中也可能生成少量NH4HCO3,该反应的化学方程式为______。
(硫酸铵化肥等级测定)
(1)判断(NH4)2SO4化肥中有无NH4HCO3:取少量试样溶于水,滴加足量的______,无气泡产生,则可判断该化肥中不存在NH4HCO3。
(2)化肥中氮元素含量的测定(已确定该化肥中不存在NH4HCO3杂质):
(查阅资料)
①已知:![]() ,氨气极易溶于水,其水溶液为氨水.氨水呈碱性,不稳定,易挥发.
,氨气极易溶于水,其水溶液为氨水.氨水呈碱性,不稳定,易挥发.
②工业判断硫酸铵化肥等级指标如下:
指标 项目 | 优等品 | 合格品 |
氮(N)含量 | ≥21.0% | ≥20.5% |
(实验设计)
按图所示装置进行实验.
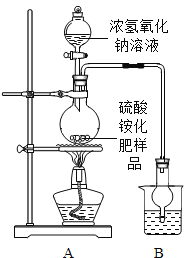
(1)实验过程中,往烧瓶中加入足量浓氢氧化钠溶液,并加热使硫酸铵充分反应完全转化为NH3.
(2)烧杯中的试剂是为了吸收产生的氨气,下列最适宜的试剂是______(填序号);
①水;②浓HCl;③稀H2SO4;④NaOH溶液
烧杯中干燥管的作用是______。
(交流讨论)
实验小组的同学认为,用上述实验装置测得的结果可能会出现下列情况.
(1)甲同学认为:应在实验装置A、B之间增加一个装有______(填“浓硫酸“或“碱石灰”)的干燥装置,否则实验测得的硫酸铵化肥含氮量可能偏高.
(2)乙同学认为:在实验装置A、B之间增加正确的干燥装置后进行实验,测得的硫酸铵化肥含氮量可能偏低,理由是______。
(实验测定)
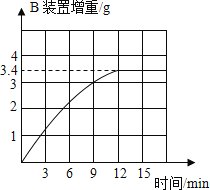
经讨论后,他们改进了实验装置,排除了可能产生误差的因素,重新进行实验。取硫酸铵化肥样品13.5 g进行实验,测得B装置增重与反应时间的关系如图所示.请通过计算判断该化肥的等级.计算过程:_____;该化肥的等级为______品。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】随着生活水平的提高,人们对环境和食品安全越来越关注。
(1)由上汽集团自主研发的“叶子”概念车(如图所示),该车顶部的“大叶子”是一部光电转化器,把光能转化为_____能;

(2)直饮水系统,可取水直接饮用。其中的饮用水处理步骤如图所示;
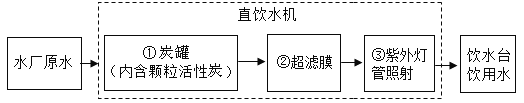
步骤①炭罐的作用是_____,步骤③对应的作用是_____;
(3)为了防止水的污染,下列各项措施中可行的是_____(填字母);
A 抑制水中所有动植物的生长
B 不任意排放工业废水
C 生活污水经处理后再排放
D 禁止使用农药和化肥
(4)SO2是空气首要污染物之一,它的危害之一是产生硫酸型酸雨,写出SO2生成硫酸的反应化学方程式:_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】a、b、c三种固体物质的溶解度曲线如图所示,请回答。
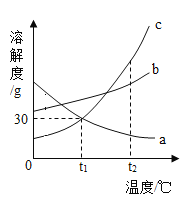
(1)若c中混有少量的b,最好采用_______的方法提纯c。
(2)气体的溶解度随温度变化的情况与______(填“a”、“乙b”或“丙c”)相似。
(3)t2℃时,a、b、c三种物质的溶解度由大到小的顺序是_______。
(4)t1℃时,向盛有15ga物质的烧杯中加入50g水,充分溶解后得到65g溶液。若要增大该溶液的溶质质量分数,可采用的方法是_____。
(5)t2℃时,将a、b、c三种物质的饱和溶液都降温到t1℃,溶液中溶质质量分数由小到大的顺序为_____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是甲、乙、丙三种固体物质的溶解度曲线,请根据溶解度曲线回答下列问题:
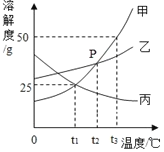
(1)交点P表示的含义是___
(2)t3℃时,将30g甲物质加入到50g水中,充分溶解后所得溶液的质量为___,溶质的质量分数为___。
(3)当甲中含有少量乙时,提纯甲的方法是___
(4)t3℃时等质量的甲、乙、丙三种物质的饱和溶液降温至t1℃,析出固体最多的物质是___。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】稀土金属因其独特的性能而被誉为“新材料之母”。稀土金属钇的氧化物(Y2O3)广泛应用于航空航天涂层材料,其颗粒大小决定了产品的质量。利用富钇稀土(含Y2O3约70%, 含Fe2O3、CuO、SiO2等约30%)生产大颗粒-氧化钇的一种工艺如下:
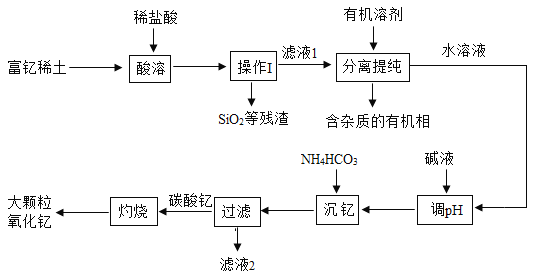
(1)操作I的名称是_____。
(2)“酸溶”过程中,氧化钇与盐酸反应的化学方程式是______。
(3)“分离提纯”是为了除去滤液1中的_____(填化学式)。
(4)“调pH”时加入碱液使溶液的pH_____(填“增大”或“减小”)。
(5)碳酸钇灼烧分解的化学方程式是_____,此反应属于基本反应类型中的_____反应。
查看答案和解析>>
科目:初中化学 来源: 题型:
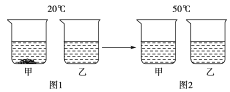
【题目】控制变量法是科学探究中常用的方法之一。
(1)在探究固体物质的溶解度时,需要考虑的因素有:①溶质的种类; ②溶剂的种类;③溶质最多被溶解的质量; ④溶剂的质量; ⑤温度。
如测定“某物质在不同温度下的溶解度”,研究的是_________ (填序号)受温度的影响,这就需要控制其他因素保持不变。
(2)右表是利用控制变量法测得的氯化钠、硝酸钾在不同温度时的溶解度,请根据表格内容及实验现象回答下列问题。
温度(℃) | 20 | 40 | 50 | |
溶解度/g | NaCl | 36.0 | 36.6 | 37.0 |
KNO3 | 31.6 | 63.9 | 85.5 | |
①从上表可知,两种物质的溶解度受温度变化影响较大的是____________;
②20℃时,将等质量的NaCl、KNO3分别放入盛有100 g水的两个烧杯中,充分溶解后如图1所示,升温到50℃时如图2所示。试判断:50℃时甲烧杯中的溶液一定是______(填“饱和溶液”、“不饱和溶液”或“不能确定”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com