
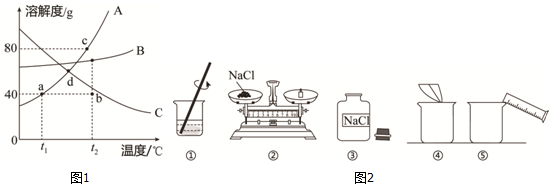
分析 根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的.
解答 解:(1)据图可以看出,对A物质来说,a点表示在t1℃时A的溶解度为40g,故填:在t1℃时A的溶解度为40g.
(2)将t1℃140gA的饱和溶液升温至t2℃时,溶液的组成不变,只是由饱和溶液变为了不饱和溶液,因此可用图上的b点表示,此时溶液是不饱和状态,然后再加入A物质40g,则恰好形成t2℃时的饱和溶液,因此可用曲线上的c点表示,据图可以看出,t2℃时A、B、C三种物质饱和溶液的质量分数由大到小的顺序是A>B>C,故填:b;不饱和;c;A>B>C.
(3)若将a点温度下A、B、C三种物质的饱和溶液降温至t1℃,由于C的溶解度随温度的降低而增大,故没有晶体析出的是C物质,故填:C.
(4)配制氯化钠溶液的正确操作顺序③②④⑤①,配制过程需要的仪器是胶头滴管和细口瓶,将100g氯化钠溶液的溶质质量分数由10%增大为20%,若保持溶剂质量不变,设需加氯化钠固体的质量是x,则有:100g×10%+x=(100g+x)×20%,x=12.5g,故填:③②④⑤①;胶头滴管、细口瓶;12.5.
点评 本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:填空题
| 药品柜编号 | ① | ② | ③ | ④ | ⑤ |
| 药品 | 氢氧化钠 氢氧化钙 | 盐酸 硫酸 | 二氧化锰 氧化铜 | 氯化钠 硫酸铜 | 锌粒 铜片 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验 | 试管1 | 试管2 | 试管3 |
| 实验操作 |  |  |  |
| 实验现象 | 铁片表面产生气泡较慢,溶液变为浅绿色 | 铬片表面产生气泡较快,溶液变为蓝色 | 无明显现象 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 固体物质的溶解度都随温度的升高而增大 | |
| B. | 一定温度下,饱和溶液增加溶剂一定变为不饱和溶液 | |
| C. | 将30 g硝酸钾投入到70 g水中,所得溶液质量一定是100 g | |
| D. | 5 g食盐完全溶于100 g水中,所得溶液中溶质的质量分数为5% |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
 某化学兴趣小组在做Fe和CuSO4溶液反应实验时,发现生成Cu的同时有气泡产生.为了进一步研究做了如下实验:
某化学兴趣小组在做Fe和CuSO4溶液反应实验时,发现生成Cu的同时有气泡产生.为了进一步研究做了如下实验:查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
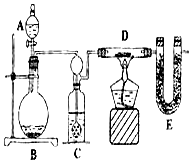 某同学为了测定水中氢、氧两元素的质量比,设计了以下实验,实验装置如图.
某同学为了测定水中氢、氧两元素的质量比,设计了以下实验,实验装置如图.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 物质都是由分子组成的 | |
| B. | 分子在不断的运动,原子不动 | |
| C. | 原子中质子数等于电子数 | |
| D. | 原子失去了电子,带负电荷,成为阴离子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com