
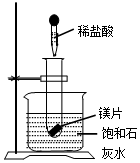
 (1)向试管中放入几小粒镁片,把试管底部伸入盛有饱和石灰水(20℃的烧杯中并固定,再向试管中滴入约5ml盐酸,如图所示,结果澄清的饱和石灰水明显变浑浊,这个实验现象产生原因是镁与盐酸反应放出热量使石灰水的温度升高,氢氧化钙的溶解度随温度的升高减小,所以会析出晶体.
(1)向试管中放入几小粒镁片,把试管底部伸入盛有饱和石灰水(20℃的烧杯中并固定,再向试管中滴入约5ml盐酸,如图所示,结果澄清的饱和石灰水明显变浑浊,这个实验现象产生原因是镁与盐酸反应放出热量使石灰水的温度升高,氢氧化钙的溶解度随温度的升高减小,所以会析出晶体.分析 (1)根据镁和盐酸反应生成氯化镁的过程放出热量,氢氧化钙的溶解度随温度的升高而减小进行分析;
(2)根据硫酸铜和氢氧化钠反应生成硫酸钠和氢氧化铜沉淀,氢氧化铜在加热的条件下生成氧化铜和水进行分析;
(3)根据在水溶液中电离出的阳离子全部是氢离子的化合物叫酸,在水溶液中电离出的阴离子全部是氢氧根离子的化合物叫碱,盐在水溶液中会电离出金属离子和酸根离子的化合物;硫酸根离子和钡离子反应会生成白色的硫酸钡沉淀进行分析.
解答 解:(1)镁和盐酸反应生成氯化镁的过程放出热量,氢氧化钙的溶解度随温度的升高而减小,所以向试管中放入几小粒镁片,把试管底部伸入盛有饱和石灰水,澄清的饱和石灰水明显变浑浊;
(2)硫酸铜和氢氧化钠反应生成硫酸钠和氢氧化铜沉淀,氢氧化铜在加热的条件下生成氧化铜和水,化学方程式为:CuSO4+2NaOH═Cu(OH)2↓+Na2SO4,Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CuO+H2O;
(3)在水溶液中电离出的阳离子全部是氢离子的化合物叫酸,在水溶液中电离出的阴离子全部是氢氧根离子的化合物叫碱,盐在水溶液中会电离出金属离子和酸根离子的化合物,所以碱式硫酸铜,化学式为Cu4(OH)6SO4,属于盐;
根据查阅的资料可以知道碱式硫酸铜为溶解度极小的物质,所以可以用蒸馏水来多次洗涤绿色沉淀至洗涤液中用BaCl2溶液检验不出SO42-后,用稀盐酸溶解绿色沉淀,此时再用BaCl2溶液检验,溶解液中有大量白色BaSO4生成,表示浅绿色沉淀中有SO42-.
故答案为:(1)镁与盐酸反应放出热量使石灰水的温度升高,氢氧化钙的溶解度随温度的升高减小,所以会析出晶体;
(2)CuSO4+2NaOH═Cu(OH)2↓+Na2SO4,Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CuO+H2O;
(3)盐;将浅绿色的浊液过滤,并把得到的绿色沉淀用蒸馏水多次洗涤,至洗涤液中用BaCl2溶液检验不出SO42-后,用稀盐酸溶解绿色沉淀,此时再用BaCl2溶液检验,溶解液中有大量白色BaSO4生成,表示浅绿色沉淀中有SO42-.
点评 本题主要考查了化学中多方面知识,难度不大,需要在平时的学习中加强记忆即可完成.


科目:初中化学 来源: 题型:选择题
| A. | 酸牛奶pH>7 | B. | 馒头、面条中含有淀粉 | ||
| C. | 鸡蛋中含有蛋白质 | D. | 蔬菜、水果中含有维生素 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
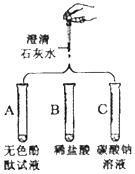 实验课上,丁丁为验证氢氧化钙的化学性质做如图所示3个实验.请回答:
实验课上,丁丁为验证氢氧化钙的化学性质做如图所示3个实验.请回答:查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 单质跟化合物反应生成新的单质和新的化合物的反应一定是置换反应 | |
| B. | 硫酸氢钠电离时产生的阳离子含氢离子,故硫酸氢钠溶液呈酸性 | |
| C. | 上述反应中,金属锌变成锌离子进入溶液,实际上是金属得到了电子 | |
| D. | 硫酸氢钠与金属锌反应后的产物是盐和氢气,符合酸的共性,硫酸氢钠属于酸类 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 离子也是构成物质的基本粒子 | B. | 燃烧并不一定要有氧气 | ||
| C. | 反应产物中有氯离子 | D. | 金属和非金属反应一定生成盐 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 在同一化合物中,金属元素一定显正价,非金属元素一定显负价 | |
| B. | 两种物质相互反应生成盐和水,证明该反应是中和反应 | |
| C. | 某物质在空气中燃烧 生成二氧化碳和水,证明该物质含碳、氢、氧三种元素 | |
| D. | 一定温度下,往氢氧化钙饱和溶液中加入氧化钙,溶质、溶剂的质量一定改变 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 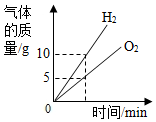 电解水得到H2与O2质量关系 | |
| B. | 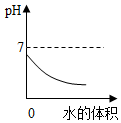 向稀盐酸中加水,溶液的pH变化 | |
| C. |  向NaOH和Na2CO3混合溶液中逐滴滴加稀盐酸 | |
| D. | 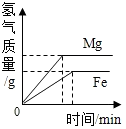 等质量的Mg和Fe与足量相同浓度的稀盐酸反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com