
黄铜是铜、锌合金,它可用来制造机器、电器零件及日用品。为测定某黄铜中铜的质量分数,现取10g该样品粉碎,加入到50g稀硫酸中,恰好完全反应,测得剩余固体质量为3.5g。计算:
(1)黄铜样品中铜的质量分数。
(2)稀硫酸中溶质的质量分数。
解:(1)黄铜样品中铜的质量分数为: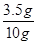 ×l00%=35% …………………(1分)
×l00%=35% …………………(1分)
(2)10g该样品中,锌的质量为:10g-3.5g=6.5g ………………………………(1分)
设稀硫酸中溶质的质量为x
Zn + H2SO4= ZnSO4 + H2↑………………………………………………………(1分)
65 98
6.5g x =
= 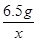 …………………………………………………………………………(1分)
…………………………………………………………………………(1分)
x ="9.8g" ……………………………………………………………………………(1分)
稀硫酸中溶质的质量分数为: ×l00%=19.6% ………………………………………………………………(1分)
×l00%=19.6% ………………………………………………………………(1分)
答:(1)黄铜样品中铜的质量分数为35%。
(2)稀硫酸中溶质的质量分数为l9.6%。,
(3)由此得到启示是:在使用黄铜制品时应注意避免与酸接触。(1分)(合理即可)
解析


科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com