


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
 (2012?贵阳)化学能改善我们的生活环境,提高生命质量,推动社会的进步.请根据所学的化学知识回答下列问题.
(2012?贵阳)化学能改善我们的生活环境,提高生命质量,推动社会的进步.请根据所学的化学知识回答下列问题.
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
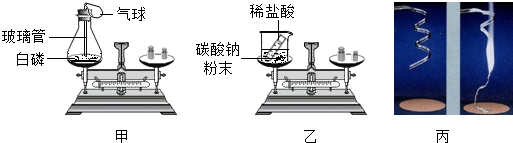
| 实验现象 | |||||||||||
| 甲同学 | ①白磷燃烧,产生浓浓的白烟,放出热量,气球先变大后又变小,天平平衡 ①白磷燃烧,产生浓浓的白烟,放出热量,气球先变大后又变小,天平平衡 |
4P+502
|
该反应遵守质量守恒定律 | ||||||||
| 乙同学 | ②烧杯内产生大量气泡,天平不平衡 ②烧杯内产生大量气泡,天平不平衡 |
③Na2CO3+2HCl=2NaCl+H2O+CO2↑ ③Na2CO3+2HCl=2NaCl+H2O+CO2↑ |
该反应遵守质量守恒定律 | ||||||||
| 丙同学 | 镁条剧烈燃烧,发出耀眼白光,放热,生成 白色固体.反应前后称量质量不相等. |
④2Mg+O2
④2Mg+O2
|
该反应不遵守质量守恒定律 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
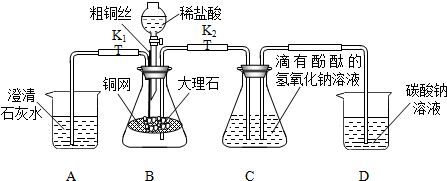
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com