
下图为镁的原子结构示意图,该元素的原子核外有________个电子层,它属于________(填“金属”或“非金属”)元素,其化学性质比较活泼,在化学反应中易________(填“得”或“失”)电子,形成________(填“阴”或“阳”)离子.
 天天练口算系列答案
天天练口算系列答案科目:初中化学 来源: 题型:
(6分)下图为元素周期表的部分内容,结合表中内容回答问题。
(1)12号元素镁的元素符号为 。
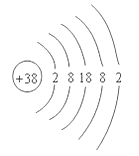
(2)氟元素的原子结构示意图为,从原子结构分析,下列元素化学性质与氟相似的是 (填序号)。
(3)某种钠原子的相对原子质量为23,该钠原子核内的中子数为 。
(4)小红取一瓶氢气和一瓶氯气进行实验。首先将氢气和氯气按右图所示装置放置,抽掉玻璃片,过一会观察到 ,产生这一现象的原因是 。然后点燃一段镁条,靠近集气瓶,氢气和氯气在光照条件下发生爆炸,生成稳定的化合物氯化氢,该反应的化学方程式为 。
查看答案和解析>>
科目:初中化学 来源:江苏模拟题 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
镁合金的强度高、机械性能好。这些特性使金属镁成为制造汽车、飞机、火箭的重要材料,从而获得“国防金属”的美誉。海水提镁是国际上的主要趋势,工业流程图如下:

其步骤为:
Ⅰ.将海边大量存在的贝壳(主要成分为CaCO3 )锻烧成生石灰,并将生石灰制成石灰乳Ⅱ.将石灰乳加入到海水反应池中,经过沉降、过滤得到Mg(OH)2沉淀
Ⅲ.在Mg(OH)2沉淀中加入盐酸中和得到MgCl2溶液,再经蒸发结晶得到MgCl2?6H2O
Ⅳ.将MgC12?6H2O 在一定条件下加热得到无水MgCl2
V.电解熔融的无水MgCl2 可得到Mg
(1)请根据上述步骤回答问题:
① 写出步骤I 、Ⅲ 的有关化学方程式:
Ⅰ.贝壳锻烧成生石灰
Ⅲ.Mg(OH)2 沉淀中加入盐酸中和
② 步骤Ⅰ―V 中有分解反应的是(填写步骤序号): 。
③ 步骤Ⅲ中的蒸发是利用风吹日晒来完成的,而在实验室中进行蒸发操作需要的主要仪器有 、 、酒精灯、带铁圈的铁架台、坩埚钳等。
④ 上述海水提镁的流程中,采取了哪些措施来降低成本、减少污染的?请写出其中一点: 。
(2)回答下列问题:
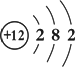
① 下图为镁元素的某种粒子结构示意图,该图表示(填序号)
A.分子 B.原子 C.阳离子 D.阴离子

② 镁原子在化学反应中容易失去电子,镁是一种(填“活泼”或“不活泼”) 金属,除了能与氧气反应,还可以与氮气、二氧化碳等反应。
(3)为测定约含镁30%的镁铝合金(不含其它元素)中镁的质量分数。
① 第一小组设计下列实验方案:称量ag镁铝合金粉末,放在如下图所示装置的惰性电热板上,通电使其充分灼烧。

讨论一:欲计算镁的质量分数,该实验中还需测定的一种数据是 。讨论二:若用空气代替O2 进行实验,对测定结果(填“有”或“无”) 影响。② 第二小组设计下列实验方案:称取bg镁铝合金,与足量的稀盐酸完全反应。欲计算镁的质量分数,该实验中还需测定的一种数据是 。
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
以下是甲、乙两同学对有关镁与盐酸反应的系列研究
研究一:镁与盐酸反应过程中的能量变化以及反应速率的变化:
(1)实验时需将镁条进行打磨,其目的是 。
(2) 反应中试管外壁发烫,说明镁与稀盐酸反应是 反应(填“吸热”或“放热”),化学方程式为
(3)实验测得镁片产生气体的速率(v)与时间(t)的关系如图所示,则t1~t2时间内反应速率逐渐加快的主要原因是 。
研究二.反应后所得溶液的酸碱性探究
【发现问题】
(1)反应后甲同学用pH试纸测定试管中溶液的酸碱性,发现pH小于7,说明甲同学所得溶液呈 性,(选填“酸”“碱”或“中”)。
(2)反应后乙同学的试管中镁条有剩余,向试液中滴入两滴酚酞溶液,振荡显红色,说明乙同学所得溶液呈 性。对此现象,乙同学重复如上实验,得到同样结果。
【提出猜想】
甲同学:猜想Ⅰ:稀盐酸过量,使溶液pH小于7;猜想Ⅱ:氯化镁溶液pH小于7。
乙同学:猜想Ⅰ:氯化镁溶液使酚酞变红色; 猜想Ⅱ:镁与热水反应使酚酞变红色。
【实验与思考】
为验证猜想,甲、乙两同学均需测定________溶液的酸碱性,实验表明该溶液显弱酸性。
乙同学为完成猜想Ⅱ,在滴有两滴酚酞的热水中放入一段打磨过的镁条,观察到溶液很快变为红色,同时还观察到镁条表面有气体生成,收集并点燃该气体,发现能燃烧,请根据实验现象写出镁与水反应的化学反应方程式 。
【结论】
镁与稀盐酸反应,镁反应完全后所得溶液显酸性;
镁与稀盐酸反应,镁过量时所得溶液显碱性。
【拓展与延伸】
(1)金属氯化物的水溶液可能显中性或弱酸性;与金属的活动性顺序有关,如氯化钠溶液显中性,氯化镁溶液显弱酸性,氯化钾溶液显________性。
(2)活泼金属能与水在一定条件下反应。实验发现钠与冷水剧烈反应,产生大量的气体。由此可见金属与水反应与金属的活动性顺序_________(填“有关”或“无关”)。
研究三. 金属活动性强弱与原子结构的关系
下图为镁原子、钙原子和钡离子结构示意图,据此推测,这三种金属的活动性最强的是
_________________。
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
以下是甲、乙两同学对有关镁与盐酸反应的系列研究
研究一:镁与盐酸反应过程中的能量变化以及反应速率的变化:
(1)实验时需将镁条进行打磨,其目的是 。
(2) 反应中试管外壁发烫,说明镁与稀盐酸反应是 反应(填“吸热”或“放热”),化学方程式为
(3)实验测得镁片产生气体的速率(v)与时间(t)的关系如图所示,则t1~t2时间内反应速率逐渐加快的主要原因是 。
研究二.反应后所得溶液的酸碱性探究
【发现问题】
(1)反应后甲同学用pH试纸测定试管中溶液的酸碱性,发现pH小于7,说明甲同学所得溶液呈 性,(选填“酸”“碱”或“中”)。
(2)反应后乙同学的试管中镁条有剩余,向试液中滴入两滴酚酞溶液,振荡显红色,说明乙同学所得溶液呈 性。对此现象,乙同学重复如上实验,得到同样结果。
【提出猜想】
甲同学:猜想Ⅰ:稀盐酸过量,使溶液pH小于7;猜想Ⅱ:氯化镁溶液pH小于7。
乙同学:猜想Ⅰ:氯化镁溶液使酚酞变红色; 猜想Ⅱ:镁与热水反应使酚酞变红色。
【实验与思考】
为验证猜想,甲、乙两同学均需测定________溶液的酸碱性,实验表明该溶液显弱酸性。
乙同学为完成猜想Ⅱ,在滴有两滴酚酞的热水中放入一段打磨过的镁条,观察到溶液很快变为红色,同时还观察到镁条表面有气体生成,收集并点燃该气体,发现能燃烧,请根据实验现象写出镁与水反应的化学反应方程式 。
【结论】
镁与稀盐酸反应,镁反应完全后所得溶液显酸性;
镁与稀盐酸反应,镁过量时所得溶液显碱性。
【拓展与延伸】
(1)金属氯化物的水溶液可能显中性或弱酸性;与金属的活动性顺序有关,如氯化钠溶液显中性,氯化镁溶液显弱酸性,氯化钾溶液显________性。
(2)活泼金属能与水在一定条件下反应。实验发现钠与冷水剧烈反应,产生大量的气体。由此可见金属与水反应与金属的活动性顺序_________(填“有关”或“无关”)。
研究三. 金属活动性强弱与原子结构的关系
下图为镁原子、钙原子和钡离子结构示意图,据此推测,这三种金属的活动性最强的是
_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com