
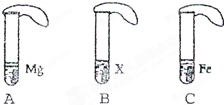
 在相同条件下,金属与酸发生反应的速率越快,金属的活动性就越强.为了探究金属Mg、Fe和某金属X等三种金属的活动性顺序,研究性学习小组设计了如下实验(如图).
在相同条件下,金属与酸发生反应的速率越快,金属的活动性就越强.为了探究金属Mg、Fe和某金属X等三种金属的活动性顺序,研究性学习小组设计了如下实验(如图).| 编号 | A | B | C |
| 现象 | 金属表面有大量气泡冒出,气球膨胀速度快 | 金属表现无气泡冒出,气球不膨胀 | 金属表面有气泡冒出,气球膨胀速度较慢 |


科目:初中化学 来源: 题型:
| Ti | Mg | Ag | |
| 实验现象 | 产生气泡速度缓慢 | 产生气泡速度快 | 无任何现象 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 金属 | Ti | Mg | Ag |
| 实验现象 | 产生气泡速度缓慢 | 产生气泡速度快 | 无任何现象 |
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
| Ti | Mg | Cu | |
| 与盐酸反应现象 | 放出气泡速度缓慢 | 放出气泡速度快 | 无现象 无现象 |
结论 |
原假设中 a a 不正确(填“a”、“b”、“a b”)理由是钛与盐酸反应放出气泡速度缓慢 钛与盐酸反应放出气泡速度缓慢 镁与盐酸反应放出气泡速度快 镁与盐酸反应放出气泡速度快 ;三种金属的活动性顺序为Mg Mg >Ti Ti >Cu Cu . | ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com