
科目:初中化学 来源: 题型:解答题
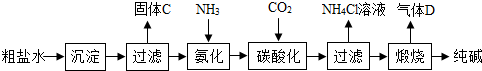
查看答案和解析>>
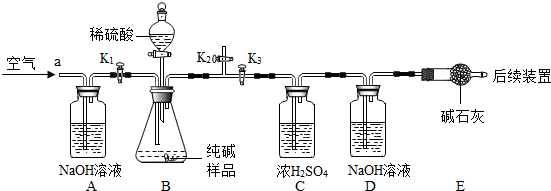
科目:初中化学 来源: 题型:解答题
 ”内,使其形成一个更为完整的复分解反应的知识网络.
”内,使其形成一个更为完整的复分解反应的知识网络.
| 物质 | 在溶剂A中的溶解度 | 在溶剂B中的溶解度 |
| AgNO3 | 170 | 86 |
| Ba(NO3)2 | 9.3 | 97.2 |
| AgCl | 1.5×10-4 | 0.8 |
| BaCl2 | 33.3 | 约为0 |
查看答案和解析>>
科目:初中化学 来源: 题型:
溶液的应用非常广泛K2CO3和KNO3在不同温度时的溶解度及其溶解度曲线如下:
| 温度/℃ | 20 | 30 | 50 | 60 | 80 |
|
| 溶解度/g | K2CO3 | 110 | 114 | 121 | 126 | 139 |
| KNO3 | 31.6 | 45.8 | 85.5 | 110 | 169 |
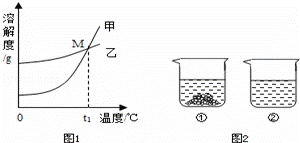
(1)图1中能表示KNO3溶解曲线的是 (填“甲”或“乙”)
(2)曲线上M点的含义是 .
(3)40℃时,向两个分别盛有相同质量的硝酸钾和碳酸钾的烧杯中,各加入100g水,充分溶解后,恢复至40℃,其结果如图2所示.下列有关说法中,正确的有 .
A.烧杯①中溶解的是KNO3,烧杯②中溶解的是K2CO3
B.烧杯②中溶液是不饱和溶液
C.若将烧杯①中的溶液变为不饱和溶液,溶液中溶质质量分数一定减小
D.将得到的烧杯②中溶液降温至20℃时,溶液中溶质质量分数可能不变.
查看答案和解析>>
科目:初中化学 来源: 题型:
溶液的应用非常广泛.K2CO3和KNO3在不同温度时的溶解度及其溶解度曲线如下:
| 温度/℃ | 20 | 30 | 50 | 60 | 80 |
|
| 溶解度/g | K2CO3 | 110 | 114 | 121 | 126 | 139 |
| KNO3 | 31.6 | 45.8 | 85.5 | 110 | 169 |
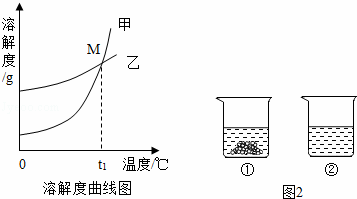
(1)硝酸钾溶液中的溶剂是 .
(2)图中能表示KNO3溶解度曲线的是 (填“甲”或“乙”).
(3)溶解度曲线上M点的含义是 .
(4)现有200g溶质质量分数为10%的碳酸钾溶液,若使溶液的溶质质量分数增加一倍,应该蒸发掉 g水.
(5)40℃时,向两个分别盛有相同质量的硝酸钾和碳酸钾的烧杯中,各加入100g水,充分溶解后,恢复至40℃,其结果如图2所示.下列有关说法中,正确的是 D (填字母序号).
A.烧杯②中溶液一定是不饱和溶液
B.若使烧杯①中固体全部溶解,溶液中溶质质量分数一定增大
C.将烧杯②中溶液降温至20℃时,溶液中溶质质量分数可能增大
D.若将烧杯①中的溶液变为不饱和溶液,溶液中溶质质量分数可能增大.
查看答案和解析>>
科目:初中化学 来源: 题型:
溶液的应用非常广泛.K2CO3和KNO3在不同温度时的溶解度及其溶解度曲线如下:
| 温度/℃ | 20 | 30 | 50 | 60 | 80 |
|
| 溶解度/g | K2CO3 | 110 | 114 | 121 | 126 | 139 |
| KNO3 | 31.6 | 45.8 | 85.5 | 110 | 169 |
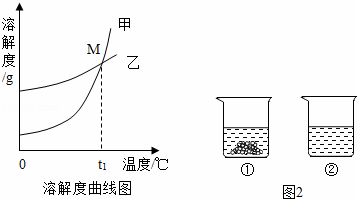
(1)硝酸钾溶液中的溶剂是 .
(2)图中能表示KNO3溶解度曲线的是 (填“甲”或“乙”).
(3)溶解度曲线上M点的含义是 .
(4)现有200g溶质质量分数为10%的碳酸钾溶液,若使溶液的溶质质量分数增加一倍,应该蒸发掉 g水.
(5)40℃时,向两个分别盛有相同质量的硝酸钾和碳酸钾的烧杯中,各加入100g水,充分溶解后,恢复至40℃,其结果如图2所示.下列有关说法中,正确的是 D (填字母序号).
A.烧杯②中溶液一定是不饱和溶液
B.若使烧杯①中固体全部溶解,溶液中溶质质量分数一定增大
C.将烧杯②中溶液降温至20℃时,溶液中溶质质量分数可能增大
D.若将烧杯①中的溶液变为不饱和溶液,溶液中溶质质量分数可能增大.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com