
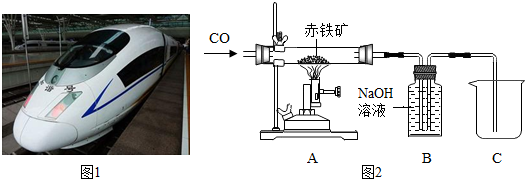
分析 (1)根据反应物与生成物进行分析解答;
(2)Ⅰ.根据一氧化碳具有可燃性,与空气混合,加热可能会发生爆炸进行分析;
Ⅱ.根据一氧化碳在高温下与氧化铁反应生成铁和二氧化碳进行分析;
Ⅲ.根据氢氧化钠的性质,装置B中的氢氧化钠溶液可以把尾气中的二氧化碳全部除去,同时把剩余的一氧化碳气体收集,以防止一氧化碳排出而污染空气.
解答 解:(1)电解氧化铝生成铝和氧气,该反应符合“一变多”的特征,属于分解反应,故选:B;
(2)Ⅰ.一氧化碳具有可燃性,与空气混合,加热可能会发生爆炸,所以在加热前要先通一氧化碳排尽玻璃管内空气,防止一氧化碳不纯发生爆炸;
Ⅱ.在高温条件下,一氧化碳与氧化铁反应生成铁和二氧化碳,化学方程式为:3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
Ⅲ.装置B内盛有氢氧化钠溶液可以除去尾气中的二氧化碳,同时一氧化碳气体排出装置内的溶液而被收集,防止造成空气污染.
故答案为:①B;
②Ⅰ先通CO;
ⅡFe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
Ⅲ收集CO.
点评 本题难度不大,考查学生根据反应原理书写化学方程式、判定反应类型的能力,掌握化学方程式的书写方法、四种基本反应类型的特征即可正确解答本题.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 如图是铁丝在氧气中燃烧的实验,回答下列问题:
如图是铁丝在氧气中燃烧的实验,回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:推断题
 已知:A是相对分子质量最小的氧化物,D是天然气的主要成分(由碳、氢两种元素组成).请分析A、B、C、D、E五种物质之间的变化关系,回答有关问题.
已知:A是相对分子质量最小的氧化物,D是天然气的主要成分(由碳、氢两种元素组成).请分析A、B、C、D、E五种物质之间的变化关系,回答有关问题.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 如图形象地表示了氯化钠的形成过程,下列相关叙述不正确的是( )
如图形象地表示了氯化钠的形成过程,下列相关叙述不正确的是( )| A. | Na与Na+的化学性质不同 | |
| B. | 钠跟氯气反应生成氯化钠 | |
| C. | 氯化钠是由离子构成的 | |
| D. | 钠原子得到一个电子形成阳离子,氯原子失去一个电子形成阴离子 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com