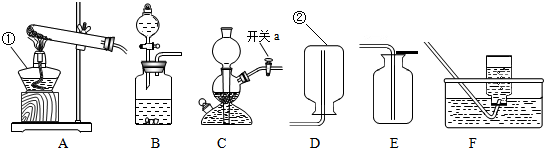
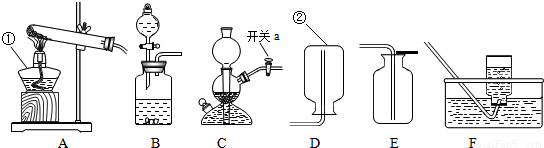
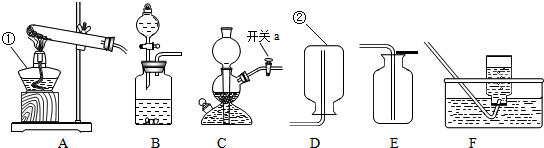
解:(1)给仪器加热的仪器是酒精灯,收集气体的仪器是集气瓶;
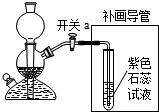
(2)实验过程中关闭开关a,会形成密闭系统而气体仍然产生,却出不来,容器内气体增多,导致压强增大;
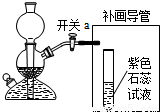
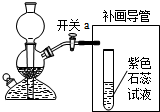
(3)补画导管需要将二氧化碳与水反应,所以要将导管通入溶液中,二氧化碳与水反应生成碳酸,碳酸属于酸能使紫色石蕊试液变红;
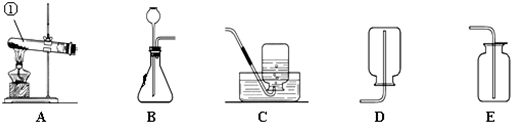
(4)反应物的状态是固体和液体,不需要加热,如果固体与固体反应制取气体需要加热,双氧水和二氧化锰是固体和液体不需要加热;收集方法的选择是根据:难溶于水或不易溶于水用排水法收集,密度比空气大用向上排空气法收集,密度比空气小用向下排空气法收集,由于氧气不易溶于水,密度比空气大,所以用排水法收集或向上排空气法收集;
(5)解设过氧化氢的物质的量为X
2H
2O
2
2H
2O+O
2↑
2 1
X 0.5mol
根据:
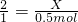
解得X=1mol
过氧化氢的质量为:1mol×34g/mol=34g
故答案为:
(1)①酒精灯;②集气瓶;
(2)反应还在继续,容器内气体增多;
(3)
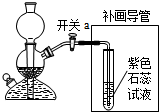
;有气泡冒出,试液变红;
(4)BE或BF;
(5)1mol;34.
分析:(1)熟记常见仪器的名称;
(2)根据关闭开关a会形成密闭系统来考虑;
(3)补画导管需要将二氧化碳与水反应,所以要将导管通入溶液中,根据二氧化碳与水反应的产物考虑溶液的变色情况;
(4)根据发生装置的选择方法和收集装置的选取方法来选取装置图;
(5)根据分子数之比等于物质的量之比求出物质的量,根据物质的量与质量的关系算出质量.
点评:通过回答本题知道了常见仪器的名称,发生装置的选择方法和收集装置的选取方法,了解了关于物质的量和质量的计算方法.

 2H2O+O2↑
2H2O+O2↑ 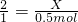 解得X=1mol
解得X=1mol ;有气泡冒出,试液变红;
;有气泡冒出,试液变红;

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案