
【题目】有一种工业废水,其中含有大量的硫酸亚铁,少量的硫酸铜以及污泥。某同学设计了一个既经济又合理的方法回收铜和硫酸亚铁晶体。方案流程如下:
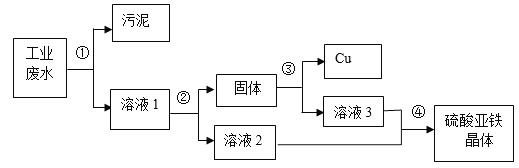
查阅资料得知硫酸亚铁晶体化学式为:FeSO47H2O,该物质受热易失去结晶水。请回答:
(1)步骤①②③中最后都需进行的实验操作是________________;
(2)步骤②中需加入的物质是_________,发生反应的化学方程式是__________________,固体的成分是______________;
(3)步骤③中需加入稀硫酸,发生反应的化学方程式是____________________________;
(4)步骤④的操作是_________________________________。
【答案】 过滤 铁粉 Fe+CuSO4==FeSO4+Cu Fe和Cu Fe+H2SO4==FeSO4+H2↑ 蒸发浓缩,冷却结晶,过滤(冷却热饱和溶液,过滤)
【解析】(1). 过滤可将两固体与液体分离, (2).实验要回收铜和硫酸亚铁晶体,所以步骤②中需加入的物质是铁粉 (3). 铁和硫酸铜反应生成硫酸亚铁和铜,发生反应的化学方程式是Fe+CuSO4==FeSO4+Cu (4).为将硫酸铜完全反应,加热的铁粉是过量的,所以反应后固体是 Fe和Cu (5). 加入的稀硫酸和铁反应生成硫酸亚铁和氢气,发生反应的化学方程式是 Fe+H2SO4==FeSO4+H2↑ (6). 将硫酸亚铁从溶液分离出来的操作步骤是蒸发浓缩,冷却结晶,过滤(冷却热饱和溶液,过滤)


科目:初中化学 来源: 题型:
【题目】甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线如图所示:
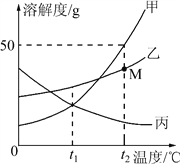
(1)t1℃时,甲、乙、丙三种固体物质的溶解度的大小关系是__________;
(2)t2℃时,将30 g物质甲加入到50 g水中,形成的溶液的质量为__________ g;
(3)t2℃时,将甲、乙、丙三种物质的饱和溶液降温到t1℃,仍为饱和溶液的是__________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】金属材料与人类的生产和生活密切相关。请回答:
(1)下列用品中,主要利用金属导电性的是_____(填序号)。
A.铂金饰品 B.铁锅 C.铝导线
(2)生活中的铝合金比纯铝的硬度_____(填“大”或“小”);铁制品锈蚀的过程,实际上是铁跟空气中的氧气和______________发生化学反应的过程。
(3)在氯化铜和氯化亚铁的混合溶液中加入一定质量的镁粉,充分反应后过滤,得到滤渣和滤液。
①滤液中一定含有的溶质是_____(填化学式)。
②向滤渣中滴加稀盐酸,有气泡产生,则滤渣中一定含有的物质是_____(填化学式)。
(4)将足量的稀盐酸加入一定量的铁、铜混合物中,下图是实验过程生成气体或剩余固体的质量随反应时间的变化关系,其中表示正确的是_____(填序号)。

(5)某同学将铁片放入CuSO4溶液中,发现铁片表面有红色物质析出,同时还有少量无色无味气泡产生。对于产生气泡的“异常现象”,下列猜想不合理的是____(填序号)。
A.产生的气体可能是H2 B.产生的气体可能是CO2
C.CuSO4溶液中可能含有少量的某种酸 D.CuSO4溶液的pH 小于7
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是硝酸钾和氯化钠的溶解度曲线图,请回答:

(1)P点表示的含义是__________________________________;
(2)20℃时向50g水中加入25g硝酸钾,充分溶解后所得溶液为________溶液(填“饱和”或“不饱和”);请计算此时溶液的溶质的质量分数,写出计算过程,结果保留1位小数;
(3)将饱和的KNO3溶液倒入小试管中,然后放入盛水的烧杯中,当向水中加入某物质后,试管中有晶体析出(如图)。加入的物质可能是下列中的__________(填字母序号)。

A.氢氧化钠固体 B.生石灰固体 C.冰块
D.硝酸铵固体 E.浓硫酸
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某兴趣小组同学准备进行常见酸、碱、盐性质实验时,发现实验台上有一瓶失去瓶塞并且标签破损的液体药品(如图),于是决定对这瓶溶液的成分进行实验探究:
【提出问题】这瓶溶液是什么溶液?
【获得信息】酸、碱、盐的性质实验中用到含钠元素的物质是氯化钠、氢氧化钠、碳酸钠。
【提出猜想】这瓶溶液可能是:
①氯化钠溶液; ②氢氧化钠溶液; ③碳酸钠溶液。
【实验推断】
实验 | 实验操作 | 实验现象 | 实验结论和解释 |
(1) | 取样于试管中,滴加无色酚酞试液。 | 溶液呈红色 | 该溶液不可能是___________溶液, 理由是____________。 |
(2) | 另取样于试管中,滴加足量稀盐酸。 | _________ | 该溶液为碳酸钠溶液 |
(3)小青认为上述实验(2)的结论不完全正确,小组同学讨论后一致认为还需要进行如下实验:另取样于试管中,加入过量的中性CaCl2溶液,观察到有白色沉淀产生,设计这一步骤的目的是_______________;静置后,取上层清液,滴入酚酞试液,溶液呈红色。
【实验结论】这瓶溶液原来是____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】硅是信息技术的关键材料,高温下氢气与四氯化硅(SiCl4)反应可制得高纯度的硅,该反应的化学方程式为:2H2 + SiCl4 == 4HCl + Si,该反应的基本反应类型为
A. 化合反应 B. 分解反应 C. 置换反应 D. 复分解反应
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验一:根据下图回答问题。
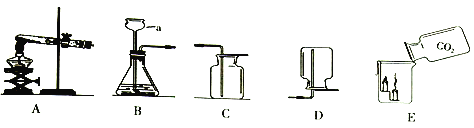
(1)仪器a的名称是__________。
(2)实验室用大理石和稀盐酸制取二氧化碳化学方程式为_________________________,选用的收集装置____________。
(3)图E所示,将二氧化碳倒入烧杯中,观察到燃烧的蜡烛现象是________________________,产生该现象的化学原因是____________________。
实验二:已知Fe2O3样品中含有杂质FeS2.兴趣小组用下图装置测定样品中FeS2含量。称取mg样品置于玻璃管Y内。充分灼烧该样品,根据实验后装置Z增加的质量推算FeS2质量(装置管内发生反应:4FeS2+11O2![]() 2Fe2O3+8SO2)
2Fe2O3+8SO2)

(4)连接好仪器,检查整套装置的气密性:在装置Z中加水至浸没长导管末端,关闭开关b,加热玻璃管Y,观察到___________________,说明装置气密性良好。
(5)使用“实验一 ”装置B制得的氧气进行实验,装置X瓶内需盛放的干燥剂是________________。
玻璃管Y内反应完全后,停止加热,若立即停止通入氧气,会导致误差,其原因是___________。
(6)若将通入的氧气改为空气进行同样的实验(样品反应完全),则测得FeS2含量__________(选填“偏大”“偏小”或“无影响”)数据。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com