化学上利用氢化锂(LiH)和水在常温下反应制取氢气,同时生成氢氧化锂,反应的化学方程式为:LiH+H2O=LiOH+H2↑,如果用氢化锂和水反应制氢气,现要制取10g氢气,需要氢化锂多少g?生成的LiOH能和多少g质量分数为10%的稀盐酸恰好完全反应?
解;①设要制取10g氢气,需要氢化锂的质量为x,可生成LiOH的质量为y,
LiH+H
2O=LiOH+H
2↑
8 24 2
x y 10g
∴
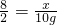
,

,
解之得:x=40g,y=120g;
②设生成的LiOH能和质量为z质量分数为10%的稀盐酸恰好完全反应,
LiOH+HCl=LiCl+H
2O
24 36.5
120g,10%z
∴
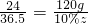
,
解之得;z=1825g.
答:现要制取10g氢气,需要氢化锂40g;生成的LiOH能和1825g质量分数为10%的稀盐酸恰好完全反应.
分析:①利用氢化锂(LiH)和水反应的化学方程式和生成氢气的质量,列出比例式,就可计算出要制取10g氢气,需要氢化锂的质量和生成LiOH的质量;
②利用氢氧化锂与稀盐酸反应的化学方程式和①中计算出的LiOH的质量,列出比例式,就可计算出生成的LiOH能和质量分数为10%的稀盐酸恰好完全反应的稀盐酸溶液的质量.
点评:本题主要考查学生运用化学方程式和溶质质量分数公式综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

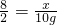 ,
, ,
,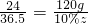 ,
,

 名校课堂系列答案
名校课堂系列答案