
 实验室常用MnO2与浓盐酸反应制备Cl2,其反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O反应装置如图甲(夹持装置已略去)
实验室常用MnO2与浓盐酸反应制备Cl2,其反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O反应装置如图甲(夹持装置已略去)分析 (1)依据反应物及制取气体的操作步骤分析解答;
(2)根据甲同学的方案:二氧化锰与浓盐酸反应生成氯化锰,也会与硝酸银反应进行分析;
乙同学的方案:依据锌粒与稀盐酸反应生成氢气进行分析解答,化学反应释放热量,气体体积具有热胀冷缩的特点.
解答 解:(1)检查装置气密性后,先加入固体,再加入液体浓盐酸,然后加热;
(2)甲同学的方案:二氧化锰与浓盐酸反应生成氯化锰,也会与硝酸银反应,所以不能用来测定残余液中盐酸的质量,反应不可行;
乙同学的方案:将锌转移到残留溶液中,反应完毕后,每间隔1分钟读取气体体积,气体体积逐渐减小,气体体积逐渐减小的原因是气体未冷却到室温,当温度冷却到室温后,气体体积不再改变;
答案:
(1)ACB;
(2)①不可行;残余液中的MnCl2也会与AgNO3反应形成沉淀;
②A;气体未冷却到室温,当温度冷却到室温后,气体体积不再改变.
点评 本题考查了对实验室制取气体的实验步骤的掌握和应用,以及依据酸的性质分析、设计实验的能力.


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:初中化学 来源: 题型:实验探究题
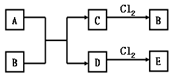 绝大多数金属都能与Cl2直接化合生成金属氯化物,如2Na+Cl2点燃═2NaCl,Cu+Cl2点燃═CuCl2等.已知A、B、C、D、E五种物质有如图转化关系(个别反应条件已略去).已知A是地壳中含量仅次于铝的金属元素的单质,C为紫红色金属单质,A、C都能与Cl2直接化合生成相应的金属氯化物B、E.回答下列问题:
绝大多数金属都能与Cl2直接化合生成金属氯化物,如2Na+Cl2点燃═2NaCl,Cu+Cl2点燃═CuCl2等.已知A、B、C、D、E五种物质有如图转化关系(个别反应条件已略去).已知A是地壳中含量仅次于铝的金属元素的单质,C为紫红色金属单质,A、C都能与Cl2直接化合生成相应的金属氯化物B、E.回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验步骤 | 设计要求 |
| ①准备两个大小相同的烧杯,分别标为A、B;向两烧杯中分别倒入30克粗细相同的食盐. | 选择合适的实验器材 |
| ②向A烧杯倒入20克水,向B烧杯倒入60克水. | 设置对照实验 |
| ③都用玻璃棒充分搅拌直到A、B两烧杯底部的食盐不再溶解为止,过滤、干燥剩余食盐 | 控制实验条件 |
| ④称量并记录,并进行统计分析. | 观察和记录 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
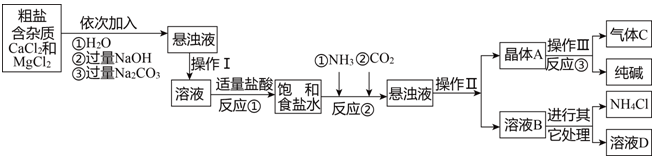
| 物质 | NaCl | NaHCO3 | NH4Cl | NH3 | CO2 |
| 溶解度 | 36.0g | 9.6g | 37.2g | 710g | 0.9g |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 溶液的总质量保持不变 | B. | 溶液中溶剂的质量保持不变 | ||
| C. | 还能继续溶解硝酸钾晶体 | D. | 剩余溶液一定是不饱和溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 | 实验结论 |
| 1、将白色粉末放于水中. | 白色粉末溶于水,形成无色溶液 | \ |
| 2、将无色酚酞滴入步骤1形成的无色溶液中. | 溶液颜色变红 | 该溶液呈碱性 |
| 3、在步骤2所形成的溶液中加入稀盐酸.并在试管口放一根燃烧的火柴. | 溶液由红色变成无色,燃烧的火柴熄灭了. | 溶液中含有碳酸根离子.白色粉末中含有氢氧化钠变质后生成的碳酸钠 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 温度/℃ | 20 | 30 | 40 | 50 | 60 | |
| 溶解度/g | 氯化钠 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
| 硝酸钾 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
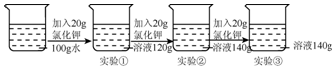
| A. | 该温度下氯化钾的溶解度是60g | |
| B. | 实验②所得溶液中溶质的质量分数为40% | |
| C. | 实验②和实验③所得溶液的浓度相同 | |
| D. | 实验①、②、③的溶液都是饱和溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com