
【题目】白铜(Cu、Ni合金)因为光泽好、耐腐蚀、容易加工等优点,常代替银做饰品。下图所示是某实验室分离废弃白铜饰品成分的流程(部分反应产物在图中已略去)。已知溶液B中含有一种二价金属化合物,溶液D中也含有一种二价金属化合物。分析该流程,回答下列问题:

(1)过程Ⅰ、Ⅱ中的实验操作名称是_____。
(2)固体C的化学式为_____。
(3)Cu、Ni、Zn的金属活动性由强到弱的顺序是_____。
科目:初中化学 来源: 题型:
【题目】基本实验与原理分析:
I.根据下图回答问题

(1)仪器a的名称是______________;
(2)选用装置①制氧气的化学方程式为__________;实验室制取二氧化碳选用的装置是______________,检验二氧化碳是否集满的操作是_____________;能用装置③收集的气体具有____________性质。
II.现有固体混合物(硝酸钾、少量氯化钠、泥沙),利用化学实验室常用仪器把硝酸钾从混合物中分离出来。回答下列问题:
(1)分离步骤为:①_____________;②趁热过滤;③冷却结晶;④再过滤;⑤洗涤晶体;⑥干燥晶体;
(2)过滤所用的玻璃仪器有玻璃棒、烧杯和_____________;
(3)趁热过滤的目的是_____________;
(4)洗涤晶体的目的是_______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请你应用质量守恒定律完成下列各题。
(1)世博会已有千辆新能源汽车投入运行,其中部分公交车采用二甲醚(C2H6O)做燃料。二甲醚分子中C、H、O元素的原子个数比为 。
(2)某化合物在纯氧中充分燃烧后,只生成水和二氧化碳,该物质中 。
A. 只含有碳元素
B. 只有氢元素
C. 一定含有碳、氢两种元素,可能含有氧元素
D. 一定有碳、氢、氧三种元素
(3)黑火药点燃时发生如下反应:2KNO3+S+3C![]() K2S+3CO2↑+X↑,其中X的化学式为 。
K2S+3CO2↑+X↑,其中X的化学式为 。
(4)下图给出的是某反应在同一容器中反应前后的分子种类。
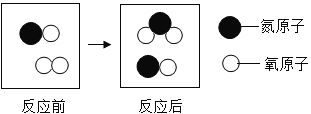
反应前 反应后
①化学反应中,参加反应的![]() 和生成的
和生成的![]() 的质量比为 。
的质量比为 。
②由此可知,在化学反应前后,一定不变的是 (填数字序号)。
a. 原子种类 b. 原子数目 c. 分子种类
d. 分子数目 e. 元素种类 f. 物质的总质量
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】以下是某化学反应的微观示意图,有关该反应的说法正确的是( )

A. 该反应中丙与丁的分子个数比为4:1 B. 该反应属于化合反应
C. 该反应前后原子的数目发生改变 D. 该反应没有单质生成
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知NaHCO3受热分解生成Na2CO3,![]() 。把12克NaHCO3和Na2CO3的混合物样品加热至完全反应,剩余固体的质量为8.9克。下列说法正确的是( )
。把12克NaHCO3和Na2CO3的混合物样品加热至完全反应,剩余固体的质量为8.9克。下列说法正确的是( )
A. 反应生成的CO2质量为4.4克B. 样品中Na2CO3的质量分数为30%
C. 样品中NaHCO3的质量为8.6克D. 样品中钠元素的质量分数为43.3%
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】用化学用语表示。
(1)空气中含量最多的气体___________;
(2)二个氩气分子__________
(3)3个亚铁离子_________;
(4)硫酸铝中铝元素的化合价为+3价________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在学习酸碱中和反应时,同学们做了稀硫酸和氢氧化钠溶液反应的实验。
(1)甲组在实验过程中测定了其中一种溶液的 pH 变化,由图可知,该小组同学测定的是_____溶液的 pH 变化,该反应的化学方程式为_____。

实验过程中,同学们取了如图中 A 点所得溶液,加入试剂_____(填序号),观察到有蓝色沉淀生成。
I、BaCl2 溶液 II. Fe2(SO4)3 溶液 III. CuSO4 溶液
结论:酸碱没有恰好中和,A 点溶液中的溶质为_____。
(2)乙组向滴有酚酞的氢氧化钠溶液中滴加稀硫酸,可观察到_____。结论:酸碱可能恰好中和,也可能硫酸过量。
为了进一步确定反应后所得溶液中是否含有硫酸,乙组同学设计了如下两种方案:
方案一:取反应后溶液于试管中,滴加碳酸钠溶液,若观察到_____,则硫酸过量;
方案二:取反应后溶液于试管中,滴加氢氧化钡溶液,若产生白色沉淀,则硫酸过量。
你认为上述两种方案,哪种不合理?并说明理由_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学学习小组为了测定某混合物(Na2CO3 与NaOH混合)中碳酸钠的质量分数,进行了如下实验:称取了20g样品配成溶液,然后逐渐加入一定量质量分数为20.8%的BaCl2溶液,充分反应,在此过程中他进行了三次数据测定,结果如下表:
测定次数 | 第1次 | 第2次 | 第3次 |
加入BaCl2溶液的质量/g | 60 | 120 | 150 |
生成沉淀的质量/g | 11.82 | 19.7 | 19.7 |
请分析数据,回答下列问题:
(1)第1次实验后所得溶液中溶质为_________;
(2)求样品中碳酸钠的质量分数____________(写出计算过程)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小明在收拾实验室时发现有一瓶没有盖瓶盖的氢氧化钙固体,报告老师后,老师告诉同学们这瓶固体可能已经变质了。于是小明和小组的同学们一起探究这瓶久置于空气中的氢氧化钙固体的成分。
(提出问题):久置于空气中的氢氧化钙固体的成分?
(猜 想):猜想 1:氢氧化钙 猜想 2:碳酸钙 猜想 3:_______
(实验验证):
实验步骤 | 实验现象 | 实验结论 |
(1)取少量固体样品于试管中,加入一定的水振荡,静置 | ||
(2)取步骤(1)中的上层清液,滴加 2-3 滴无色酚酞试液,振荡 | ______ | 样品中含有氢氧化钙 |
(3)往上面试管中的剩余固体中倒入足量的稀盐酸 | ______ | 样品中含有碳酸钙 |
(得出结论):猜想 3 正确
(实验反思):上述实验中产生气泡的化学方程式为:______
(拓展提升):进一步探究这瓶氢氧化钙固体的变质程度,计算固体样品中氢氧化钙的质量分数?
(实验设计):小明和同学们设计了如下图所示的实验装置来测定样品中氢氧化钙的质量分数(铁架台、 铁夹等在图中均已省略)
(资料):饱和碳酸氢钠溶液可以吸收盐酸挥发出来的 HCl 气体;碱石灰为 NaOH 和 CaO 的混合物;装置 F 用于吸收空气的气体
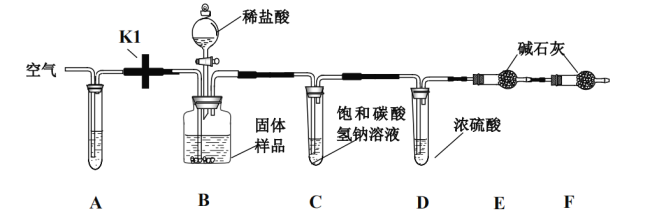
(实验步骤):
①准确称量 10.0g 固体样品装入装置 B
②将装置 B 分别与 A、C、D 连接,打开开关 K1,从 A 处鼓入空气,几分钟后,将开关 K1 关闭,再将已 称量过的干燥管 E、F 与 D 连接
③打开 B 中分液漏斗的活塞,再向 B 中缓缓的注入足量的稀盐酸
④待完全反应后,再次打开开关 K 缓缓鼓入空气几分钟,最后称量干燥管 E,增重 1.1g
(实验分析)
(1)已知装置 A 中试剂为某种碱性溶液,其作用是为了吸收空气中的某气体,写出吸收该气体所发生的
化学反应方程式:______________,实验前第一次鼓入空气是为了驱赶装置中的该气体,若反应后不鼓入空气,对测定结果的影响是_____________(填“偏大”或“偏小”)
(2)D 装置的作用是_____。
(3)根据干燥管 E 增加的质量,可推算出样品中氢氧化钙的质量分数为_______。
(4)实验结束后,同学们认为反应后的酸性废液不能直接进行排放,应该进行处理以后再排放,正确的处理方法是加入过量的______
A 熟石灰 B 碳酸钙 C 生石灰 D 氢氧化钠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com