
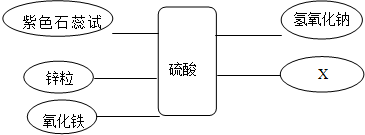

分析 (1)根据氧化铁与硫酸的化学反应正确书写化学方程式;
(2)根据酸的化学性解答;
(3)根据要求正确书写化学方程式;
(4)Ⅰ.根据氢气的质量来计算氢气的物质的量;
Ⅱ.根据化学方程式计算;
(5)根据能使酚酞变红色的溶液显碱性解答;
(6)根据氢氧化钙与盐酸反应的化学方程式,以及反应物是否有剩余等解答;
(7)根据实验现象来确定溶液成分.
解答 解:(1)氧化铁与硫酸反应生成硫酸铁和水,化学方程式为:Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;
(2)根据酸的化学性质X为能与硫酸反应的盐;
(3)图中能发生中和反应的是氢氧化钠与稀硫酸,反应的化学方程式:H2SO4+2NaOH═Na2SO4+2H2O;
(4)Ⅰ解:氢气的物质的量:0.2g÷2g/mol=0.1mol;
Ⅱ、解:设硫酸中溶质的质量为x
Zn+H2SO4═ZnSO4+H2↑
98 2
x 0.2g
$\frac{98}{2}=\frac{x}{0.2g}$
x=9.8g
酸中溶质的质量分数:$\frac{9.8g}{50g}×100%$=19.6%;
(5)能使酚酞变红色的溶液显碱性;
(6)氢氧化钙与盐酸反应生成了氯化钙和水,所加盐酸过量,故所得溶液中含有的溶质有氯化钙和氯化氢;可向溶液中滴加石蕊试液,若变红,则证明盐酸过量;
(7)丁同学将碳酸钠溶液加入氢氧化钙溶液中,充分反应后,生成了氢氧化钠和碳酸钙沉淀,故可看到产生白色沉淀,反应后溶液中的溶质有氢氧化钠.
答案:(1)Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;
(2)Na2CO3(能与硫酸反应的盐);
(3)H2SO4+2NaOH═Na2SO4+2H2O;
(4)Ⅰ、0.1mol;
Ⅱ、19.6%;
(5)碱性;
(6)氯化钙和氯化氢;向溶液中滴加石蕊试液,若变红,则证明盐酸过量;
(7)产生白色沉淀;氢氧化钠.
点评 解答本题关键是要知道酸碱指示剂遇到酸和碱变色情况,熟悉方程式的书写注意事项.


科目:初中化学 来源:2017届黑龙江省哈尔滨市毕业学年调研测试(二)化学试卷(解析版) 题型:选择填充题
如图是两种固体物质的溶解度曲线(不含结晶水,且在同一杯溶液中相互不干扰)。对此,下列判断正确的是( )
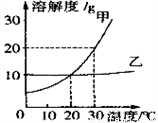
A. 甲、乙在20℃时,溶液质量分数相等
B. 30℃时,同一杯甲乙二者饱和溶液,甲溶质质量不一定比乙多
C. 分别恒温蒸发30℃时两杯溶液,析出的甲比乙多
D. 30℃时,将60g甲的饱和溶液降温到20℃时,析出5g甲物质
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com