


科目:初中化学 来源: 题型:
 下面是利用如图装置完成验证二氧化碳性质的实验.
下面是利用如图装置完成验证二氧化碳性质的实验.查看答案和解析>>
科目:初中化学 来源: 题型:
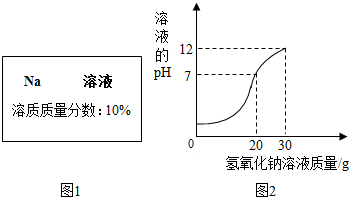 实验室有一瓶试剂,密封完好但标签残缺(如图1所示),已知它可能是NaCl,NaOH,Na2CO3,NaHCO3中的一种.
实验室有一瓶试剂,密封完好但标签残缺(如图1所示),已知它可能是NaCl,NaOH,Na2CO3,NaHCO3中的一种.| 物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
| 溶解度/g | 36 | 109 | 21.5 | 9.6 |
| 实验步骤 | 实验现象 | 结论及化学方程式 |
| 取样于试管中,滴加 | 产生大量气泡 | 该溶液是 化学方程式为 |
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
| 实验 编号 | 试剂 | 前9min内产生的氢气体积(mL) | |
| 不同纯度的锌 | 不同体积和质量分数的稀硫酸 | ||
| a | 纯锌 | 30mL30% | 564.3 |
| b | 含杂质的锌 | 30mL30% | 634.7 |
| c | 纯锌 | 30mL20% | 449.3 |
| d | 纯锌 | 40mL30% | 602.8 |

| 时段(均为1分钟) | 第1分钟 | 第2分钟 | 第3分钟 | 第4分钟 | 第5分钟 | 第6分钟 |
| H2的体积 | 33.1mL | 116.7mL | 91.9mL | 89.6mL | 77.6mL | 56.0mL |
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com