
| 反应时间/s | 0 | 30 | 60 | 90 | 120 | 150 |
| 烧杯和药品质量/g | 一定量 | 137.8 | 135.6 | m | 134.5 | 134.5 |
分析 (1)根据烧杯和药品质量的变化数据进行分析;
(2)根据质量守恒定律,计算出二氧化碳的质量,然后计算出碳酸钙的质量,再计算质量分数.
解答 解:(1)通过分析表中的数据可以看出,反应时间30s-60s烧杯和药品质量减少了2.2g,说明生成二氧化碳的质量为2.2g,所以60s-120s烧杯和药品质量减少1.1g,说明反应在85s时反应停止,反应时间90s时,固体质量是134.5g,所以m的值是134.5;反应前30s也应减少2.2g,反应时间是0s时,烧杯和药品质量为137.8g+2.2g=140g,故答案为:2.2;134.5;
(2)通过分析表中的数据可知,反应前烧杯的总质量为140g,所以石灰石样品质量为140g-100g-25g=15g,
生成二氧化碳为140g-134.5g=5.5g,
设样品中含有碳酸钙为x,生成氯化钙的质量为y,
CaCO3+2HCl═CaCl2+H2O+CO2↑,
100 111 44
x y 5.5g
$\frac{100}{x}=\frac{44}{5.5g}$
x=12.5g,
$\frac{111}{y}=\frac{44}{5.5g}$
y=13.875g
所以碳酸钙的质量分数为:$\frac{12.5g}{15g}$×100%=83.3%.
(3)反应后所得溶液的溶质质量分数为$\frac{13.875g}{12.5g+100g-5.5g}$×100%≈13.0%
故答案为:(1)2.2;134.5;(2)83.3%;(3)13.0%.
点评 解答本题的关键是能够根据表中提供的数据进行正确的判断,即反应何时进行完全,每次反应生成二氧化碳的质量是多少,这是解题的关键.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:初中化学 来源: 题型:选择题
| A. | 恰好变为无色时溶液中的溶质除酚酞外可能不止一种 | |
| B. | 恰好变为无色时溶液的PH一定等于7 | |
| C. | 原氢氧化钠溶液的PH大于10 | |
| D. | 不能使酚酞变红的溶液一定不是显碱性 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 据报道,有人将点着的鞭炮扔进排污井里,引发井内气体爆炸伤及路人.
据报道,有人将点着的鞭炮扔进排污井里,引发井内气体爆炸伤及路人.查看答案和解析>>
科目:初中化学 来源: 题型:多选题
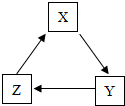 如表各组物质间能通过一步反应就能实现如图转化的是( )
如表各组物质间能通过一步反应就能实现如图转化的是( )| X | Y | Z | |
| A | H2 | H2SO4 | H2O |
| B | CuSO4 | CuCl2 | Cu(OH)2 |
| C | H2O | O2 | CO2 |
| D | Ca(OH)2 | NaOH | Na2CO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 2个氧原子:O2 | B. | 硫酸中硫元素化合价:H2$\stackrel{+6}{S}$O4 | ||
| C. | 2个铁离子:2Fe2+ | D. | 生石灰:Ca(OH)2 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 物质 | 杂质 | 除杂方法 |
| A | 铁粉 | 铜粉 | 加入足量的稀硫酸,过滤 |
| B | NaCl溶液 | NaOH溶液 | 加入适量CaCl2溶液,过滤 |
| C | CaCl2溶液 | 稀盐酸 | 加过量碳酸钙,过滤 |
| D | CaO | CaCO3 | 加入适量稀盐酸,过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com