解答:解:(1)①金属的开发和大规模利用的时间早晚与金属的活动性有关,金属越活泼,冶炼难度越大,开发和利用的时间越晚,故选择A;
②合金的熔点要比各成分金属的熔点低,硬度大,所以青铜乃铜锡合金,其熔点要比铜低,硬度要比铜大;
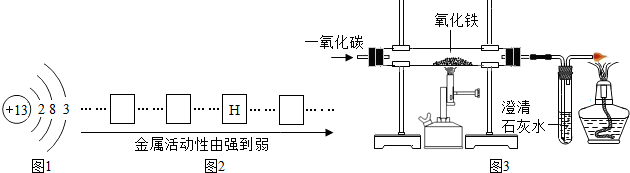
(2)在铝原子结构示意图中看出最外层电子数为3,该元素的原子在化学反应中一般要失去3个电子而形成稳定结构,因而表现出的化合价为+3价;
(3)①根据铜、铝、铁三种金属的活动性强弱关系铝>铁>氢>铜,可判断顺序表最左端空格内为铝,接下来的空格内为铁,最右端为铜;
②证明铜、铝、铁的活动性顺序选择一种金属和另两种金属的盐溶液,所以除了铁丝外,可以选择铝和铜的盐溶液,如AlCl
3、CuCl
2溶液,将铁丝伸入AlCl
3、CuCl
2溶液中,观察到在CuCl
2溶液铁的表面有红色的物质生成,而在AlCl
3溶液中无现象,则可以判断金属铁的活动性顺序比铜强,比铝弱;
③解:由镁、铝、铁三种金属分别与足量的稀盐酸反应的化学方程式Fe+2HCl═FeCl
2+H
2↑,Mg+2HCl=MgCl
2+H
2↑,2Al+6HCl=2AlCl
3+3H
2↑可知,每生成一克氢分子与需要这几种物质的比为:
Fe--1:28,Al--1:9,Mg--1:12,所以要产生相等质量的氢气,需要的铁质量最多,镁次之,铝最少;
(4)①铝的活动性比铁强,但铝在空气中却表现出良好的抗腐蚀性,是因为铝容易与空气中的氧气发生反应,会生成一层致密的氧化铝膜覆盖在铝的表面,阻止反应的进行,所以具有良好的抗腐蚀性;
②铁生锈是铁与空气中的氧气和水等物质共同作用的结果,生活中常用的铁制品防锈方法有:在铁制品表面涂上一层保护膜,在铁制品表面镀上一层其他金属,改变铁制品的内部结构,将其制成不锈钢等合金等;
生锈的铁制品放入盛有过量稀盐酸的洗槽中,观察到溶液变黄,是与铁锈反应生成氯化铁的缘故;一段时间后,有无色气泡逸出,是与铁反应产生氢气的缘故.所以溶液变黄的化学反应方程式是:Fe
2O
3+6HCl═2FeCl
3+3H
2O;
(5)①“湿法炼铜”,即“曾青得铁则化为铜”是铁和硫酸铜反应产生硫酸亚铁和铜,反应的方程式为:Fe+CuSO
4=FeSO
4+Cu;
②一氧化碳还原氧化铁(红色)产生铁(黑色)和二氧化碳,因此实验中玻璃管内的现象为:红色固体变黑色;反应的方程式为:3CO+Fe
2O
3 2Fe+3CO
2;
③根据石灰水增重的0.88g就是产生的二氧化碳的质量
设生成0.88g二氧化碳需要一氧化碳的质量为x
3CO+Fe
2O
32Fe+3CO
284 132
x 0.88g
=
x=0.56g
但在实际操作中需要多通入一氧化碳用于排空气,防止发生爆炸,后还通一氧化碳至冷却,防止氧化,故通入装置的CO气体质量一定要大于0.56g.
故答案为:(1)①A ②大
(2)失去+3
(3)①Al Fe Cu ②AlCl
3、CuCl
2溶液(答案合理即可) ③铁>镁>铝
(4)①铝表面有一层致密的氧化膜 ②涂油(答案合理即可)
Fe
2O
3+6HCl═2FeCl
3+3H
2O ③CO
2(5)Fe+CuSO
4=FeSO
4+Cu ①红色固体变黑色 3CO+Fe
2O
3 2Fe+3CO
2②0.56 g