

分析 (1)根据一氧化碳和氧化铜在加热的条件下生成铜和二氧化碳,碳和氧化铜在高温的条件下生成铜和二氧化碳进行分析;
(2)根据二氧化碳和氢氧化钙反应会生成碳酸钙沉淀,一氧化碳有毒,装置最后需要点燃或收集进行分析;
(3)根据可燃性气体和助燃性气体混合点燃可能发生爆炸进行分析;
(4)根据铜和氧气在加热的条件下生成氧化铜进行分析;
(5)根据一氧化碳和碳的化学性质进行分析.
解答 解:(1)一氧化碳和氧化铜在加热的条件下生成铜和二氧化碳,碳和氧化铜在高温的条件下生成铜和二氧化碳,所以两个实验的反应原理相似,反应条件不完全相同,CO还原氧化铜在加热条件下进行,而C还原氧化铜需在高温条件下进行.实验现象也有共同之处:都生成了二氧化碳,甲、乙中还原CuO反应的化学方程式分别为:CuO+CO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2,2CuO+C$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑;
(2)二氧化碳和氢氧化钙反应会生成碳酸钙沉淀,所以从装置上看,甲、乙均需将导管尾部插人澄清石灰水中.目的是证明有二氧化碳生成,一氧化碳有毒,装置最后需要点燃或收集,所以在装置甲中a处应连接收集装置或放置酒精灯;
(3)可燃性气体和助燃性气体混合点燃可能发生爆炸,所以在CO还原氧化铜的实验中,点燃酒精灯之前,必须先通一会儿CO(或N2),目的是:防止一氧化碳和氧气的混合气,加热发生爆炸;
(4)铜和氧气在加热的条件下生成氧化铜,所以实验结束后,甲装置中的红色物质又变成黑色物质,原因是:灼热的铜和氧气反应生成了氧化铜,发生反应的化学方程式为:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,为了防止此现象的发生.熄灯后还需继续通一氧化碳至试管冷却;
(5)通过分析可知,甲、乙两个实验说明CO和C都具有还原性,且CO的还原性强于C的还原性.他们都可用于金属冶炼工业.
故答案为:(1)加热,高温,都生成了二氧化碳,CuO+CO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2,2CuO+C$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑;
(2)二氧化碳,收集装置,酒精灯;
(3)防止一氧化碳和氧气的混合气,加热发生爆炸;
(4)红,黑,灼热的铜和氧气反应生成了氧化铜,2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,继续通一氧化碳至试管冷却;
(5)还原,还原,强于,还原,金属冶炼.
点评 本题考查了氧化铜的还原原理、反应方程式的书写、实验操作中的注意点,对学生的比较问题的能力也有考查.


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:初中化学 来源: 题型:解答题
 图所示六种途径都可以制得氧气,已知水通电生成氢气和氧气.
图所示六种途径都可以制得氧气,已知水通电生成氢气和氧气.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
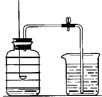 用来测定空气成分的方法很多,图所示的是小明用红磷在空气中燃烧的测定方法.实验过程是:
用来测定空气成分的方法很多,图所示的是小明用红磷在空气中燃烧的测定方法.实验过程是:查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验 | 双氧水质量(g) | 双氧水浓度 | 二氧化锰质量(g) | 收集时间(s) |
| 1 | 100 | 6% | 5 | 200 |
| 2 | 100 | 12% | 5 | 100 |
| 3 | 100 | 18% | 67 |
| 时间/秒 | 生成氧气的体积/毫升 | |||
| 0.1克MnO2 | 0.2克MnO2 | 0.3克MnO2 | 0.4克MnO2 | |
| 40 | 49 | 61 | 75 | 86 |
| 80 | 77 | 87 | 90 | 92 |
| 120 | 89 | 92 | 92 | 92 |
| 160 | 92 | 92 | 92 | 92 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com