镁在空气中生成氧化镁和氮化镁(其中氮为-3价),氮化镁与水反应生成氢氧化镁和氨气,其化学方程式为 ,12克镁在空气中燃烧所得产物的总质量 20克(填:>.<或=),已知氮化镁是黄绿色固体,根据镁条在空气中燃烧的实验现象,可知在这样条件下,镁更易与 (填“O2”或“N2”)化合,理由是生成物 .
【答案】
分析:根据反应物,生成物以及反应条件可以写出的方程式.根据化学方程式采用极端假设法对生成物的质量进行分析,根据镁在空气中燃烧的实验现象,以及空气的成分,可以知道镁更易与空气中的氧气化合.
解答:解:(1)由题意知反应物是氮化镁与水,生成物是氢氧化镁和氨气可以写出方程式为:Mg
3N
2+6H
2O=3Mg(OH)
2+2NH
3↑
(2)设12g镁与氧气完全反应生成氧化镁的质量为x,12g镁与氮气完全反应生成氮化镁的质量为y
2Mg+O
2 
2MgO 3Mg+N
2 
Mg
3N
2
48 80 72 100
12g x 12g y
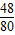
=
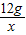
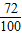
=
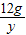
x=20g y=16.67g
故所得产物的总质量<20g
(3)镁在空气中燃烧产生白烟,判断产物主要是白色固体,是氧化镁,故在这样的条件下,镁更易与空气中的O
2化合.
故答案为:Mg
3N
2+6H
2O=3Mg(OH)
2+2NH
3↑;<;O
2;镁在空气中燃烧产生白烟,判断产物主要是白色固体,是氧化镁.
点评:解此类题首先要会根据反应物、生成物及反应条件正确书写方程式,其次要会根据方程式采用极端假设法对各物质之间的质量比分析对应物质的质量.

 2MgO 3Mg+N2
2MgO 3Mg+N2  Mg3N2
Mg3N2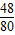 =
=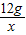
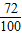 =
=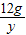


 走进文言文系列答案
走进文言文系列答案