
分析 (1)天然存在的硬度最大的物质是金刚石,进行分析解答.
(2)根据二氧化碳不能燃烧、不能支持燃烧、密度比空气的大,一氧化碳具有可燃性,进行分析解答.
(3)根据Na2CO3、NaHCO3、CaCO3等均属于碳酸盐或碳酸氢盐,进行分析解答.
解答 解:(1)天然存在的硬度最大的物质是金刚石.
(2)二氧化碳不能燃烧、不能支持燃烧、密度比空气的大,一氧化碳具有可燃性,可用于灭火的是二氧化碳.
(3)Na2CO3、NaHCO3、CaCO3等均属于碳酸盐或碳酸氢盐,跟稀盐酸反应都能生成水和二氧化碳气体.
故答案为:(1)金刚石;(2)二氧化碳;(3)二氧化碳.
点评 本题难度不大,掌握盐的化学性质、二氧化碳与一氧化碳的化学性质、碳单质的物理性质等是正确解答本题的关键.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:推断题
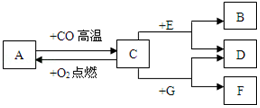
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 生活污水应集中处理达标后排放 | |
| B. | 煤、石油、天然气都是不可再生能源 | |
| C. | 回收废旧金属制品可节省资源 | |
| D. | 大量排放二氧化碳气体容易引发酸雨 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 燃烧需要可燃物接触氧气,所以可燃物接触氧气就一定能燃烧 | |
| B. | 用洗洁剂洗去油污是利用了乳化作用,用汽油洗去油污也是利用了乳化作用 | |
| C. | 溶液具有均一、稳定的特征,所以均一、稳定的液体一定是溶液 | |
| D. | 铁与稀硫酸反应后溶液质量增大,锌与稀硫酸反应后溶液质量也增大 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
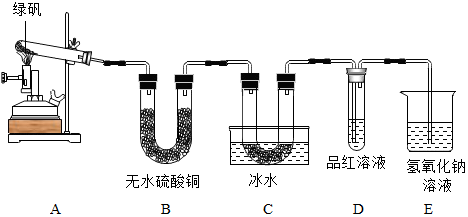
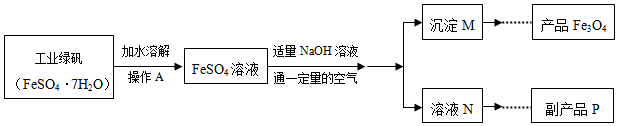

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com