
分析 据常温下碳的化学性质不活泼,随着温度的升高,碳的活动性大大增强,具有可燃性,能燃烧生成二氧化碳或一氧化碳,碳具有还原性,据此进行分析解答.
解答 解:常温下,碳的化学性质稳定性,碳受日光照射或与空气、水分接触都不容易起变化.随着温度的升高,碳的活动性大大加强;
碳在氧气中充分燃烧生成了二氧化碳,反应化学方程式为:C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2;不充分燃烧的时生成了一氧化碳,反应的化学方程式为:2C+O2$\frac{\underline{\;点燃\;}}{\;}$2CO;
碳在高温时还原氧化铜生成铜和二氧化碳,反应的化学方程式是C+2CuO$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑;
故答为:常温下化学性质稳定;C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2;2C+O2$\frac{\underline{\;点燃\;}}{\;}$2CO;C+2CuO$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑.
点评 本题只要熟练掌握了碳的化学性质和化学方程式的书写即可解题,难度不大.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
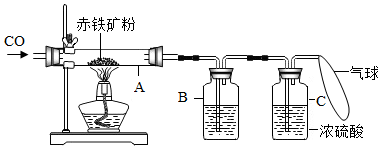 钢铁产生是我国的支柱产业之一,选择优质炼铁原料十分重要.甲、乙两组同学对某钢铁厂所购进的赤铁矿粉中主要成分Fe2O3的含量进行测定.(假设每步反应均能完全进行,赤铁矿粉中杂质性质稳定,既不溶于水也不参与反应)
钢铁产生是我国的支柱产业之一,选择优质炼铁原料十分重要.甲、乙两组同学对某钢铁厂所购进的赤铁矿粉中主要成分Fe2O3的含量进行测定.(假设每步反应均能完全进行,赤铁矿粉中杂质性质稳定,既不溶于水也不参与反应)| 方案 | 优点 |
| 甲组 | 可以用两种方法计算Fe2O3的含量 |
| 乙组 | 不用加热,节能环保且操作简单,安全系数高 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 铁在氧气中燃烧火星四射 | B. | 氢气在空气中燃烧发出淡蓝色火焰 | ||
| C. | 红磷在空气中燃烧产生大量白烟 | D. | 木炭燃烧生成二氧化碳 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com