
分析 碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳;根据质量守恒定律,混合物质量的减少的质量即生成的二氧化碳气体的质量,据此根据反应的化学方程式列式计算出参加反应硫酸的质量、参加反应的碳酸氢钠的质量、生成硫酸钠的质量,进而计算出溶质的质量分数.
解答 解:由质量守恒定律,生成二氧化碳的质量为20g+100g-111.2g=8.8g.
设参加反应硫酸的质量为x,参加反应的碳酸氢钠的质量为y,生成硫酸钠的质量为z,
2NaHCO3+H2SO4═Na2SO4+2H2O+2CO2↑
168 98 142 88
y x z 8.8g
(1)$\frac{98}{88}=\frac{x}{8.8g}$ x=9.8g
该稀硫酸的质量分数为$\frac{9.8g}{100g}×$100%=9.8%.
(2)$\frac{168}{88}=\frac{y}{8.8g}$ y=16.8g
原小苏打样品中含的NaHCO3质量分数为$\frac{16.8g}{20g}×$100%=84%.
(3)$\frac{142}{88}=\frac{z}{8.8g}$ z=14.2g
反应后溶液中溶质的质量分数为$\frac{14.2g}{16.8g+100g-8.8g}$×100%≈13.1%.
答:(1)该稀硫酸的质量分数为9.8%.
(2)原小苏打样品中含的NaHCO3质量分数为84%.
(3)反应后溶液中溶质的质量分数为13.1%.
点评 本题难度不大,本题难度不大,掌握利用化学方程式与溶质质量分数的综合计算即可正确解答本题,根据质量守恒定律计算出二氧化碳的质量是正确解答本题的前提和关键.


科目:初中化学 来源: 题型:解答题
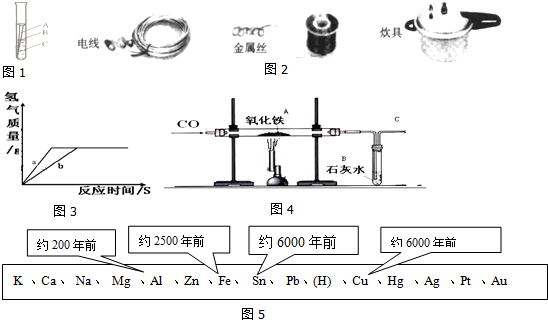
| 反应时间 | t0 | t1 | t2 | t3 |
| 烧杯和药品的质量/g | 166.5 | 166.3 | 166.1 | 166.1 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
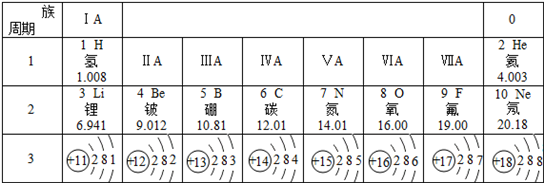
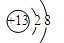 ;与该离子电子层结构相同的带一个单位负电荷的阴离子的符号是F-;
;与该离子电子层结构相同的带一个单位负电荷的阴离子的符号是F-;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com