
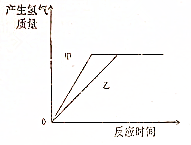
 足量的镁、铁分别与等量的稀硫酸反应,反应的方程式Mg+H2SO4═MgSO4+H2↑、Fe+H2SO4═FeSO4+H2↑,反应速率较快的是镁,则在图中甲表示镁,乙是铁.
足量的镁、铁分别与等量的稀硫酸反应,反应的方程式Mg+H2SO4═MgSO4+H2↑、Fe+H2SO4═FeSO4+H2↑,反应速率较快的是镁,则在图中甲表示镁,乙是铁. 分析 根据金属镁和硫酸反应生成硫酸镁和氢气,铁和硫酸反应生成硫酸亚铁和氢气,在金属活动性顺序中,氢前的金属能与酸反应生成氢气,金属的位置越靠前,反应的速率越快进行解答.
解答 解:金属镁和硫酸反应生成硫酸镁和氢气,反应的方程式为Mg+H2SO4═MgSO4+H2↑;铁和硫酸反应生成硫酸亚铁和氢气,反应的方程式为Fe+H2SO4═FeSO4+H2↑;在金属活动性顺序中,氢前的金属能与酸反应生成氢气,金属的位置越靠前,反应的速率越快,在金属活动性顺序中,镁>铁,所以镁的反应速率快,则在图中甲表示镁,乙是铁.故填:Mg+H2SO4═MgSO4+H2↑;Fe+H2SO4═FeSO4+H2↑;镁;镁;铁.
点评 本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行.


科目:初中化学 来源: 题型:选择题
| A. | 氧气的化学性质比较活泼,氧气属于可燃物 | |
| B. | 氮气的化学性质不活泼,可用于充入灯泡中以延长使用寿命 | |
| C. | 空气质量报告中所列的空气质量级别越高,污染指数越大,表明空气质量越好 | |
| D. | 二氧化碳在空气属于污染物,它在空气中含量增多会引起温室效应 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
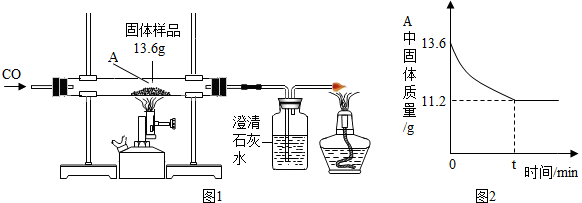
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用工业酒精配制白酒饮用 | B. | 将燃气热水器安装在浴室内 | ||
| C. | 向蔬菜大棚内通入适量的CO2 | D. | 用胆矾对饮用水进行消毒 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
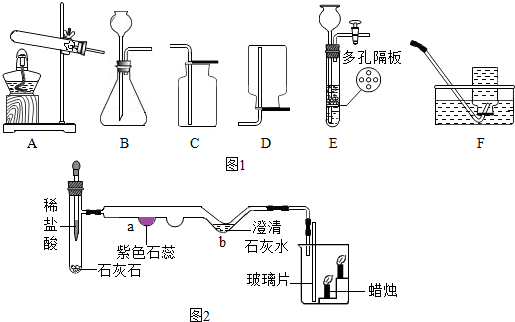
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
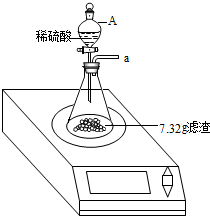 某兴趣小组对月饼包装盒中的“脱氧剂”很好奇,他们观察“脱氧剂”外包装标注的成分为铁粉、活性炭和氯化钠,打开发现灰黑色的固体中还夹杂着少量红棕色粉末.
某兴趣小组对月饼包装盒中的“脱氧剂”很好奇,他们观察“脱氧剂”外包装标注的成分为铁粉、活性炭和氯化钠,打开发现灰黑色的固体中还夹杂着少量红棕色粉末.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com