
分析 根据碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳,结合质量守恒定律,烧杯内质量的减少的质量即生成的二氧化碳质量,据此根据反应的化学方程式列式计算出参加反应碳酸钙的质量,进而计算出骨灰样中碳酸钙的质量分数.
解答 解:(1)根据质量守恒定律,烧杯内质量的减少的质量即生成的二氧化碳质量,反应过程中产生的二氧化碳质量为69g+29.2g-93.8g=4.4g;
(2)设骨灰试样中碳酸钙的质量为x,
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 4.4g
$\frac{100}{x}$=$\frac{44}{4.4g}$
x=10g
骨灰试样中碳酸钙的质量分数为$\frac{10g}{69g}$×100%=14.5%.
故答案为:(1)4.4;
(2)骨灰试样中碳酸钙的质量分数为14.5%.
点评 本题难度不大,掌握根据化学方程式的计算即可正确解答本题,根据质量守恒定律计算出二氧化碳的质量是正确解答本题的前提和关键.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 试管外壁应该干燥,试管里的液体不应超过试管容积的$\frac{1}{3}$ | |
| B. | 用试管夹夹持试管时,应由试管底部套上、取下 | |
| C. | 加热时,应先使试管底部均匀受热,然后用酒精灯的内焰固定加热 | |
| D. | 试管口不能对着自己和他人 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
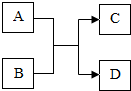 A、B、C、D都是初中化学种常见的物质,A、C组成元素相同的两种气体氧化物,D为紫红色金属单质.它们之间的相互转化关系如图(图中反应条件已略去).则:
A、B、C、D都是初中化学种常见的物质,A、C组成元素相同的两种气体氧化物,D为紫红色金属单质.它们之间的相互转化关系如图(图中反应条件已略去).则:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com