
分析 (1)根据稀释前后溶液中溶质的质量不变结合密度公式可以完成解答;
(2)根据铁与硫酸反应的生成硫酸亚铁及氢气的特点,写出铁与硫酸反应的化学方程式;
(3)根据反应的化学方程式,由反应中铁与硫酸的质量关系,列出参加反应铁的质量的计算比例式;
(4)利用生成中所含铁的质量,计算该生铁中含铁的质量分数;
(5)反应后所得溶液为硫酸亚铁溶液,最终溶液中溶质的质量分数=$\frac{反应生成硫酸亚铁的质量}{反应后所得溶液质量-蒸发水的质量}$×100%,根据反应的化学方程式计算生成硫酸亚铁的质量,根据质量守恒定律计算反应后所得溶液的质量;
(6)铁矿石的利用率为90%即铁矿石中铁元素质量的90%被转化为生铁,根据生铁中所含铁元素的质量即铁矿石中所含铁元素质量的90%,由铁矿石计算所得生铁质量.
解答 解:
(1)设需要浓度为98%的硫酸质量是x
x×98%=10g×9.8%
x=100g
需要水的质量=100g-10g=90g,
(2)铁与硫酸反应生成硫酸亚铁和氢气,化学方程式为Fe+H2SO4═FeSO4+H2↑;
(3)lOOg 9.8%的稀硫酸中含硫酸的质量=100g×9.8%=9.8g
Fe+H2SO4═FeSO4+H2↑
56 98
x 9.8g
$\frac{56}{98}=\frac{x}{9.8g}$
x=5.6g
(4)解得x=5.6g,即生铁样品中含铁5.6g
该生铁中含铁的质量分数=$\frac{5.6g}{5.6g+1.4g}$×100%=80%;
(5)设恰好完全反应时,生成硫酸亚铁的质量为y,生成氢气的质量为z
Fe+H2SO4═FeSO4+H2↑
98 152 2
9.8g y z
$\frac{98}{9.8g}=\frac{152}{y}=\frac{2}{z}$
解得y=15.2g,z=0.2g
最终溶液中溶质的质量分数=$\frac{15.2g}{5.6g+100g-0.2g-5.4g}$×100%=15.2%;
(6)生铁的质量=$\frac{10t×80%×\frac{112}{160}×100%×90%}{80%}$=6.3t
答案:
(1)90 g
(2)Fe+H2SO4═FeSO4+H2↑
(3)$\frac{56}{98}$=$\frac{X}{9.8g}$
(4)80%
(5)15.2%
(6)6.3t
点评 根据反应的化学方程式能表示反应中各物质的质量比,由反应中某物质的质量可计算出反应中其它物质的质量.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:选择题
| 序号 | 物质 | 杂质(少量) | 试剂和操作方法 |
| A | O2 | H2O | 通过浓H2SO4,洗气 |
| B | 稀盐酸 | 稀硫酸 | 加入过量BaCl2溶液,过滤 |
| C | CaO粉末 | CaCO3粉末 | 加入稀盐酸 |
| D | NaOH溶液 | Na2CO3溶液 | 加入适量的CaCl2溶液,过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 ”为铜片):
”为铜片):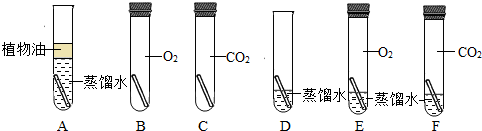
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 需要区分的物质 | 实验方法 |
| A | 硬水和蒸馏水 | ①观察颜色 ②加肥皂水 |
| B | 黄铜片和铜片 | ①观察颜色 ②加稀盐酸 |
| C | 涤纶布和棉布 | ①灼烧,闻气味 ②用手摸 |
| D | 硝酸铵和氢氧化钠 | ①加水看是否溶解 ②加熟石灰研磨、闻气味 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
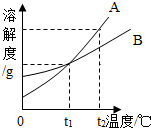 如图为A、B两种物质(均不含结晶水)的溶解度曲线,下列说法错误的是( )
如图为A、B两种物质(均不含结晶水)的溶解度曲线,下列说法错误的是( )| A. | tl℃时,A、B的溶解度相等 | |
| B. | t2℃时,A、B的饱和溶液降温到tl℃时,析出A的质量一定比B多 | |
| C. | A、B两种物质的溶解度都随温度升高而增大 | |
| D. | 当A中含有少量B时,可以用冷却热饱和溶液的方法提纯A |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
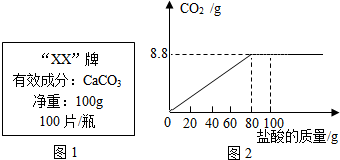 钙是人体中的常量元素,缺钙时可通过使用保健药剂来增加摄入量,某补钙药剂说明书的部分信息如图所示.现将100g盐酸分成5等份,逐次加到用40片该药剂制成的粉末中(其他成分不参与盐酸反应),得到部分数据与图象如下.请根据有关信息回答问题.
钙是人体中的常量元素,缺钙时可通过使用保健药剂来增加摄入量,某补钙药剂说明书的部分信息如图所示.现将100g盐酸分成5等份,逐次加到用40片该药剂制成的粉末中(其他成分不参与盐酸反应),得到部分数据与图象如下.请根据有关信息回答问题. | 第1次 | 第3次 | 第4次 | 第5次 | |
| 加入盐酸的质量(g) | 20 | 20 | 20 | 20 |
| 剩余固体的质量(g) | 35 | a | 20 | 20 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前的质量/g | 90 | 11 | 5 | 8 |
| 反应后的质量/g | 36 | M | 35 | 32 |
| A. | 乙一定是催化剂 | B. | 该反应是分解反应 | ||
| C. | 该反应是化合反应 | D. | 反应中甲、丙质量比为15:27 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用过滤的方法软化硬水 | |
| B. | 用蒸发的方法区分食盐水和蒸馏水 | |
| C. | 用灼烧法鉴别棉纤维和羊毛纤维 | |
| D. | 通过磁铁吸引鉴别易拉罐是铝制还是铁制 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com