31、某火力发电厂以煤为燃料,充分燃烧后将热能转化为电能,其排出的废气中含有CO
2、SO
2、水蒸气等.已知SO
2既能使品红溶液褪色,又能使澄清石灰水变混浊.因SO
2有还原性,故还能被高锰酸钾溶液氧化而除去,无水硫酸铜与水由白变蓝.为了检验该发电厂排出的废气中的成分,用如图所示的装置进行实验.
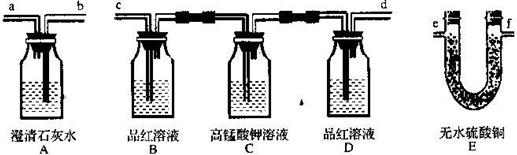
(1)仪器连接的顺序为(填导管接口字母)
efcdba
(2)根据
B中品红溶液褪色
现象能证明有SO
2存在.
(3)根据
D
中无明显变化和装置A中
澄清石灰水变浑浊
现象证明有CO
2存在.
(4)把装置E放置在最后,能否证明该废气中含有水蒸气?
不能
,理由是
因为A、B、C、D中的水蒸气可能随气流进入E中
.
(5)装置B作用是
检验SO2气体
,装置D的作用是
检验SO2是否被除尽
.
(6)写出装置A中发生反应的化学方程式:
CO2+Ca(OH)2=CaCO3↓+H2O
.

