



 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
| ||

查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 时间/h | 1 | 1.5 | 4 | 8 | 12 | 24 | 48 | 60 | |
| 吸水质量/g | 硫酸甲 | 1.6 | 2.2 | 5.2 | 10.3 | 14.0 | 20.9 | 29.2 | 32.1 |
| 硫酸乙 | 1.2 | 1.5 | 3.5 | 5.9 | 8.1 | 12.9 | 19.5 | 21.0 | |
| 溶液中可能含有的离子 | 设计实验验证(实验步骤、现象及对应的结论) |
SO42- SO42- |
取少量滤液,加入硝酸钡溶液,若有白色沉淀产生,说明溶液中含有SO42-;若无白色沉淀产生,说明溶液中不含有SO42-. 取少量滤液,加入硝酸钡溶液,若有白色沉淀产生,说明溶液中含有SO42-;若无白色沉淀产生,说明溶液中不含有SO42-. |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
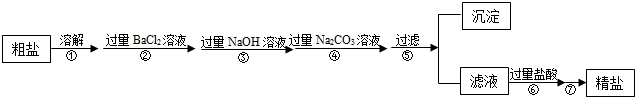
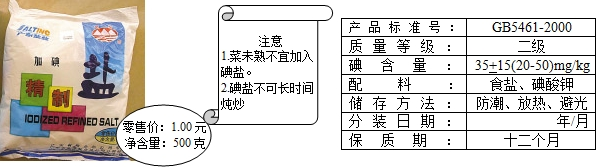
查看答案和解析>>
科目:初中化学 来源: 题型:单选题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com