
科目:初中化学 来源: 题型:解答题
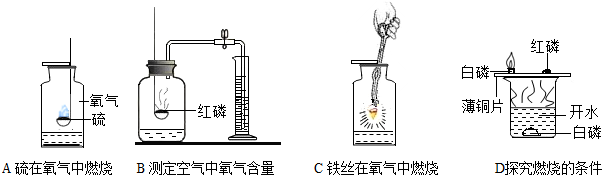
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
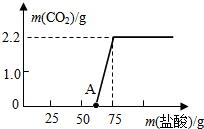 某校研究性学习小组进行了一个有趣的实验探究:
某校研究性学习小组进行了一个有趣的实验探究:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 33.3% | B. | 66.7% | C. | 80% | D. | 74% |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
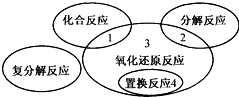 在化学反应中,反应前后元素化合价发生变化的反应就是氧化还原反应.氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于区域3的是( )
在化学反应中,反应前后元素化合价发生变化的反应就是氧化还原反应.氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于区域3的是( )| A. | Fe2O3+3H2SO4═Fe2(SO4)3+3H2O | B. | NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O+CO2↑ | ||
| C. | CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O | D. | Fe+2HCl═FeCl2+H2↑ |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 血红蛋白质中含有铁元素,缺铁会引起人体贫血 | |
| B. | 回收废弃的塑料可以减少白色污染 | |
| C. | NaCl和NaNO2有咸味,都可用作食物的调味品 | |
| D. | 在发酵的面团中加入小苏打以提高馒头的口感和除去酸味 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
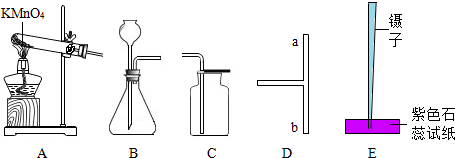
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com