
| 106 |
| x |
| 44 |
| 4.4g |
| 10.6g |
| 12g |


科目:初中化学 来源: 题型:
| 盐酸 体积:500mL 化学式:HCl 相对分子质量:36.5 密度:1.2g/cm3 质量分数:37%(1)用该浓盐酸100ml能配制质量分数为20%的盐酸 (2)利用刚配制的稀盐酸来测定某碳酸钠样品的纯度(样品不含氢元素):取50g该样品,向其中滴入刚配好的稀盐酸至不再产生气泡为止,共用去盐酸146g. ①发生反应的化学方程式 ②利用已知条件求解参加反应的固体物质质量(x)的比例式 ③该样品的成分是 ④该样品的纯度是 ⑤若向反应后溶液中加入46.8g水后,此时所得溶液中溶质的质量分数为 查看答案和解析>> 科目:初中化学 来源: 题型: 为测定某碳酸钠样品(其中杂质不溶于水)纯度,进行了以下实验:取48g样品加入水使碳酸钠完全溶解后除去杂质,将得到的液体平均分为四份,每份中分别加入一定质量的氯化钙溶液,反应的化学方程式为CaCl2+Na2CO3=CaCO3↓+2NaCl,实验数据见下表.
(1)每份液体完全反应时,生成沉淀的质量为 (2)样品中碳酸钠的纯度. 查看答案和解析>> 科目:初中化学 来源: 题型: (2013?历下区二模)已知某碳酸钠样品中含有少量的氯化钠杂质,化学兴趣小组为测定该碳酸钠样品的纯度,设计了如图所示的实验: 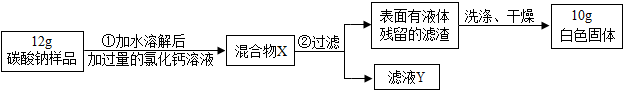 (1)在第 ①步操作中观察到的明显现象是 有白色沉淀生成 有白色沉淀生成 .(2)滤液Y中的溶质是 氯化钠和氯化钙 氯化钠和氯化钙 .(3)若过程 ①所加氯化钙溶液的量不足,则计算出的碳酸钠样品的纯度将 偏小 偏小 (填“偏大”、“偏小”或“不受影响”).(4)根据实验数据,计算样品中碳酸钠的质量(计算结果精确到0.1克). 查看答案和解析>> 科目:初中化学 来源: 题型: 现有一瓶标签如图所示的浓盐酸,请根据标签上的数据回答 问题: (1)用该浓盐酸100ml能配制质量分数为20%的盐酸 g (2)利用刚配制的稀盐酸来测定某碳酸钠样品的纯度(样品不含氢元素): 取50g该样品,向其中滴入刚配好的稀盐酸至不再产生气泡为止, 共 用去盐酸146g,然后将所得溶液蒸干得到的固体纯净物27.2g。 ①发生反应的化学方程式 ; ②利用已知条件求解参加反应的固体物质质量(x)的比例式 ; ③该样品的成分是 ; ④该样品的纯度是 ; ⑤若向反应后溶液中加入46.8g水后,此时所得溶液中溶质的质量分数为 。
查看答案和解析>> 同步练习册答案 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区 违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com版权声明:本站所有文章,图片来源于网络,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请作者速来函告知,我们将尽快处理,联系qq:3310059649。 ICP备案序号: 沪ICP备07509807号-10 鄂公网安备42018502000812号 |