
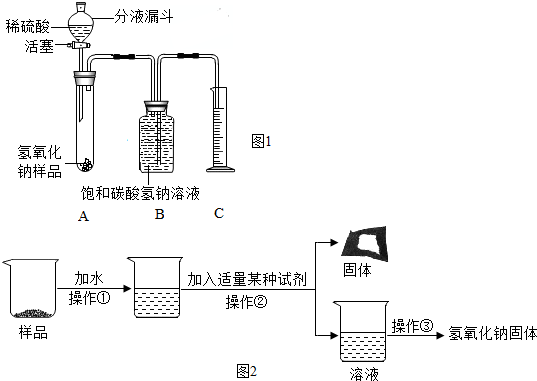
分析 【实验探究1】(1)根据做实验时连接好仪器一定要检查装置的气密性进行分析;
(2)根据实验目的“通过测二氧化碳的体积来计算药品中碳酸钠的含量”进行分析;
(3)根据二氧化碳在空气中的含量分析;
(4)根据量筒中收集到饱和二氧化碳水溶液220mL即为反应生成的二氧化碳的体积,由此,生成二氧化碳的质量为:220 mL/1000×2 g/L=0.44g.根据二氧化碳的质量及反应的化学方程式便可求出碳酸钠的质量,就能得出样品中碳酸钠的质量分数;
【实验探究2】(1)根据操作的特点分析;玻璃棒加速溶解;
(2)根据除去氢氧化钠中的碳酸钠方法分析;
(3)根据由方程式分析;
【实验反思】根据实验步骤分析.
解答 解:【实验探究1】(1)做有气体参与的连续性实验的一般步骤是,连接装置→检验装置气密性→装药品→做实验.
(2)本题的实验目的是通过测二氧化碳的体积来计算药品中碳酸钠的含量,所以必须保证二氧化碳的准确性,因为二氧化碳可以溶于水,所以用饱和的碳酸氢钠水溶液,可以避免二氧化碳的减少.
(3)空气中含有的二氧化碳量很少,不会对结果产生大的影响;
(4)解:生成二氧化碳的质量为:$\frac{220}{1000}$×2g/L=0.44g
设样品中含碳酸钠的质量为x
Na2CO3+H2SO4=Na2SO4+CO2↑+H2O
106 44
x 0.44g
$\frac{106}{x}$=$\frac{44}{0.44g}$
解之得:x=1.06g
∴样品中碳酸钠的质量分数=$\frac{1.06g}{2g}$×100%≈53%
【实验探究2】(1)操作①的名称为溶解、②的名称为过滤、③的名称为蒸发,为了使样品充分溶解,可用玻璃棒搅拌;
(2)碳酸钠能与石灰水反应生成碳酸钙沉淀和氢氧化钠,能除去杂质且没有引入新的杂质,方程式为Na2CO3+Ca(OH)2=CaCO3↓+2NaOH.
(3)根据反应看出,变质生成的碳酸钠通过反应生成氢氧化钠,最终所得氢氧化钠固体质量比变质后样品中氢氧化钠的质量多.
【实验反思】定性检验氢氧化钠的变质要选择试剂种类、注意实验装置与步骤的计划;定量测定变质样品中某成分的含量时要确定试剂用量,实验中还要考虑实验安全环保问题、测量中减少误差问题.
故答案为:【实验探究1】(1)检查装置的气密性;
(2)避免二氧化碳溶解在水里而损耗,造成测定结果偏低;
(3)没有
(4)53%
【实验探究2】(1)溶解、过滤、蒸发;玻璃棒;
(2)Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
(3)大于;
【实验反思】①②④⑤⑥.
点评 熟练掌握碳酸钠、碳酸钙等碳酸盐和氢氧化钠、氧化钙的化学性质,能根据所给的实验或者自己设计实验来验证它们是否变质,并熟练的写出相应的化学方程式.


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:初中化学 来源: 题型:选择题
| A. | 乘坐公共交通工具携带酒精 | |
| B. | 不慎碰倒酒精灯,酒精在桌面燃烧,用湿抹布来灭火 | |
| C. | 液化气着火,首先迅速关闭液化气罐阀门 | |
| D. | 炒菜时油锅着火用锅盖盖灭 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 水在生产和生活中起着十分重要的作用.
水在生产和生活中起着十分重要的作用.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
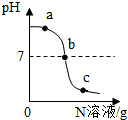 已知M,N分别是稀硫酸、氢氧化钠溶液中的一种.某化学兴趣小组同学在一定量的M中不断滴加N,并测定所得溶液的pH,如图所示.
已知M,N分别是稀硫酸、氢氧化钠溶液中的一种.某化学兴趣小组同学在一定量的M中不断滴加N,并测定所得溶液的pH,如图所示.| 实验步骤 | 实验现象 | 结论 |
| 取少量该溶液,向其中滴加紫色石蕊溶液 | 溶液变红色 | 为c处溶液,并推知溶液中的阳离子有 Na+、H+、SO42(填离子符号) |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验操作 | 实验现象 | 实验结论 |
①取少量样品溶于水,加入过量的氯化钙溶液 | 有白色沉淀产生 | 该反应的化学方程式:Na2CO3+CaCl2═CaCO3↓+2NaCl |
| ②将上述反应后的混合物过滤,取滤液,加入酚酞试液 | 溶液变红色 | 证明猜想Ⅱ正确 |

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 除去NaCl中少量的Na2CO3杂质,先加入足量稀盐酸,再蒸发结晶 | |
| B. | 稀释浓硫酸时,将水沿烧杯壁慢慢注入浓硫酸中并用玻璃棒不断搅拌 | |
| C. | 实验测定某矿石中碳酸钙的质量分数,先加入硫酸,再比较反应前后的质量变化 | |
| D. | 氧化铜粉末、炭粉、铁粉三种黑色粉末用一种试剂无法鉴别 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 牛奶在空气中久置后产生酸味 | |
| B. | 铁制水龙头渗漏引起白色洗面盆滴水处发黄 | |
| C. | 家庭装修、装饰材料散发出难闻气味 | |
| D. | 旅游城市标志青铜奔马(马踏飞燕)变绿 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com