
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:初中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
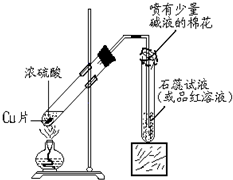 某化学兴趣小组的同学在探究金属铜的化学性质时,发现铜与稀硫酸在常温或短时间加热的条件下均不反应.那么铜与浓硫酸能否发生反应?他们设计了如图所示装置进行探究.
某化学兴趣小组的同学在探究金属铜的化学性质时,发现铜与稀硫酸在常温或短时间加热的条件下均不反应.那么铜与浓硫酸能否发生反应?他们设计了如图所示装置进行探究.| H2SO4(浓) |
| △ |
| O2 |
| △ |
| H2SO4(稀) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com