
| 实验操作 | 实验现象 | 实验结论 |
| ①取少量样品于试管中,加入适量盐酸,塞上带导管的单孔塞 把导管插入另一试管里的石灰水中. | 有气体产生,气体使石灰水变浑浊. | 猜想2 成立 |
| ②在上述反应后的试管 中加少量品红溶液. | 品红溶液褪色. |
分析 【猜想】
根据题目信息可知,漂白粉的主要成分是Ca(ClO)2、CaCl2,Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO,其部分变质,所以一定有生成的碳酸钙,还有未反应的CaCl2,和部分未反应的Ca(ClO)2;
【实验探究】要证明碳酸钙的存在,可以加入稀盐酸,并将生成气体通入澄清的石灰水;要检验是否含有Ca(ClO)2,可根据HClO是一种酸性比盐酸弱的酸,不稳定,具有漂白性,能使品红等有色物质褪色设计实验;
【交流与反思】(1)HClO是一种酸性比盐酸弱的酸,在常温下分解,反应为2HClO=2HCl+O2↑,分析溶液pH的变化;
(2)根据漂白粉与稀盐酸反应生成次氯酸和氯化钙写出反应的方程式;.
解答 解:【猜 想】根据题目信息可知,漂白粉的主要成分是Ca(ClO)2、CaCl2,Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO,其部分变质,所以一定有生成的碳酸钙,还有未反应的CaCl2,和部分未反应的Ca(ClO)2;
故答案为:CaCO3;
【实验探究】要证明猜想2成立,就是设计实验检验碳酸钙和次氯酸钙的存在;根据实验现象:有气体产生,气体使石灰水变浑浊;说明是在样品中加入稀盐酸,碳酸钙与盐酸反应生成二氧化碳使澄清的石灰水变浑浊;在上述反应后的试管中加少量品红溶液,根据(3)分析,盐酸与Ca(ClO)2 反应生成HClO,而HClO具有漂白性,能使品红等有色物质褪色;
故答案为:
| 实验操作 | 实验现象 | 实验结论 |
| ①取少量样品于试管中,加入适量盐酸,塞上带导管的单孔塞, 把导管插入另一试管里的石灰水中. | 有气体产生,气体使石灰水变浑浊. | 猜想2成立 |
| ②在上述反应后的试管中加少量品红溶液. | 品红溶液褪色. |
点评 本题考查了根据题目信息分析解答问题的能力,有关实验方案的设计,是中考的热点之一,要依据信息结合已有的知识仔细分析解答.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
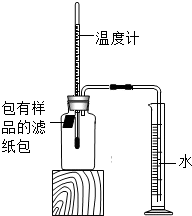 小明对铁的锈蚀进行如下探究,室温时,将包有样品的滤纸包用大头针固定在橡胶塞上,迅速塞紧,装置如图,观察到量筒内水沿导管慢慢进入广口瓶(净容积为146mL).当温度恢复至室温,且量筒内水面高度不变时读数(此时瓶内氧气含量近似为零).记录起始和最终量筒的读数以及所需时间如表.
小明对铁的锈蚀进行如下探究,室温时,将包有样品的滤纸包用大头针固定在橡胶塞上,迅速塞紧,装置如图,观察到量筒内水沿导管慢慢进入广口瓶(净容积为146mL).当温度恢复至室温,且量筒内水面高度不变时读数(此时瓶内氧气含量近似为零).记录起始和最终量筒的读数以及所需时间如表.| 序号 | 样品 | 量筒起始 读数/mL | 量筒最终 读数/mL | 所需时间 /min |
| 1 | 1g铁粉、0.2g碳和10滴水 | 100 | 70 | 约120 |
| 2 | lg铁粉、0.2g碳、10滴水和少量NaCl | 100 | 70 | 约70 |
| 3 | 1g铁粉、10滴水 | 100 | 70 | 约480 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
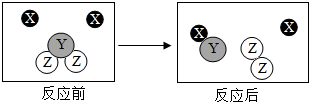 如图是某化学变化的微观示意图,X、Y、Z分别表示不同类别的原子,据图回答问题:
如图是某化学变化的微观示意图,X、Y、Z分别表示不同类别的原子,据图回答问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验操作 | 实验现象 | 实验结论 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com