
(7分)中和反应是中学化学中重要的学习内容,其在日常生活和工农业生产中有广泛的应用。
(1)下图表示盐酸和氢氧化钠溶液发生反应过程中溶液的pH的变化曲线。请从曲线图中获取信息,回答下列问题:
①图1图象表示盐酸和氢氧化钠溶液发生反应过程中溶液的pH变化。进行该反应的实验操作是按照图2中的 (填甲或乙)图所示进行的。
②曲线上M点表示 。
③向烧杯中倾倒20g质量分数为4.00%的氢氧化钠溶液,滴入3滴酚酞试液,振荡,再逐滴滴入质量分数为3.65%的稀盐酸,边滴边振荡,直至溶液刚好变为 色为止,共用去稀盐酸20g,则反应后溶液中溶质质量分数为 (结果精确到0.1%)。
(2)为证明中和反应是放热反应,某小组进行了如图所
示的实验操作: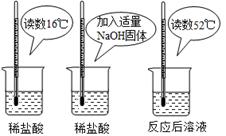
根据上图实验,甲同学认为:NaOH与稀盐酸发生的中和反应是放热反应。乙同学认为:甲同学得出
这个结论的依据不科学,理由是 。
(3)为探究影响中和反应放出热量多少的因素,他们又进行了如下实验:在编号为A、B、C、
D、E的五只烧杯中各装入36.5g 溶质质量分数为5%、10%、15%、20%、25%的盐酸,
再向上述五只烧杯中分别加入40g20% 的氢氧化钠溶液,最后测量其温度,数据记录如下:
| 烧杯编号 | A | B | C | D | E |
| 盐酸的溶质质量分数 | 5% | 10% | 15% | 20% | 25% |
| 反应后溶液温度(℃) | 24℃ | 34℃ | 46℃ | 54℃ | 54℃ |
(1)①乙 ②盐酸和氢氧化钠恰好完全反应 ③无 2.9%
(2)氢氧化钠固体溶于水也会放出大量的热
(3)盐酸的浓度越大,放出的热量越多 E
解析试题分析:①从图1图象可知,该反应开始时是碱性,随着另一种物质的加入溶液逐渐变为中性至酸性;所以反应应为向氢氧化钠溶液中加盐酸。即进行该反应的实验操作是按照图2中的乙图所示进行的。
②曲线上M点对应的PH值为7,表示盐酸和氢氧化钠恰好完全反应。
③开始的氢氧化钠溶液呈碱性,可使无色酚酞变红。根据化学方程式计算可知:当加入的稀盐酸20 g时,二者恰好完全反应,溶液呈中性显无色。
根据题意可知,已知量为:氢氧化钠的质量;未知量为反应后溶液中溶质(为氢氧化钠与盐酸反应生成的氯化钠)质量分数。
解题思路:可根据二者在反应中的质量关系,先求解出生成氯化钠的质量。根据反应可知,所得溶液的质量为所用的氢氧化钠溶液的质量和稀盐酸溶液的质量的和。可进一步求出溶液中溶质的质量分数。具体解题过程为:
解:设生成氯化钠的质量为x
NaOH + HCl====NaCl+H2O
40 58.5
20g×4.00% x
40:58.5=(20g×4.00%):x
x=1.17g
所得溶液中溶质的质量分数为: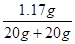 ×100%≈2.9%
×100%≈2.9%
(2)氢氧化钠固体溶解于水时,也能放出热量,所以不能确认是氢氧化钠与稀盐酸反应放热。
(3)根据表中数据可知:当盐酸的浓度越大的时,反应后溶液的温度越高;所以可说明盐酸的浓度越大,放出的热量越多。
交流反思:根据氢氧化钠与盐酸反应的质量关系可知:当盐酸的质量分数为20%时,二者恰好完全反应,所以所得的D溶液为中性;ABC三溶液为碱性;E为酸;所以反应后,烧杯内溶液pH最小的是E。
考点:图像题、中和和反应、综合计算


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:初中化学 来源: 题型:计算题
(7分)工业上通常用黄铁矿(主要成分FeS2)为原料生产硫酸,先将黄铁矿粉碎,然后按照以下流程制备硫酸: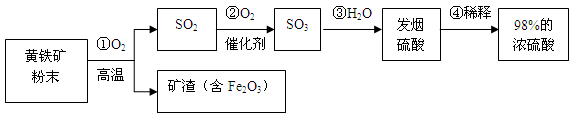
⑴ 先将黄铁矿石粉碎的目的是 。
⑵ 写出稀释浓硫酸的具体操作步骤 。
⑶ 将10g98%的浓硫酸稀释成9.8%的稀硫酸,需要加水 g。
⑷ 取20g矿渣样品(含Fe2O3),向其中加入300g溶质质量分数为9.8%的稀硫酸(已知矿渣中的Fe2O3与稀硫酸恰好完全反应得到Fe2(SO4)3溶液),试通过化学方程式计算该矿渣样品中Fe2O3的质量分数。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(10分)市售珍珠粉的价格相差很大,但其外观、手感都没有明显差异,优质珍珠粉和廉价珍珠粉的成分有何不同呢?实验小组同学展开探究。
【查找资料】
①优质珍珠粉直接由贝科动物体内珍珠加工而成,含有一定量的氨基酸、碳酸钙等。
②廉价珍珠粉由“贝壳粉”加工而成,贝壳加工过程中会用到氢氧化钠,贝壳的主要成分是碳酸钙。
③珍珠粉中除碳酸钙外,其它成分均不能与盐酸反应生成二氧化碳。
④氨基酸大部分能溶解于水,遇到浓硝酸并加热会呈现黄色或黑色。
⑤碳酸钙与浓硝酸能发生反应,生成二氧化碳。
⑥氯化钙溶液呈中性。
【提出猜想】优质珍珠粉和廉价珍珠粉的区别可能在于:
①廉价珍珠粉含有 ;
②廉价珍珠粉不含氨基酸;
③碳酸钙含量不同。
【实验探究】
| 实 验 内 容 | 现 象 | 结 论 |
| (1)分别将少量优质珍珠粉和廉价珍珠粉放入试管中,加少量水,静置一段时间后,滴加 。 | 廉价珍珠粉的上层清液变红,优质珍珠粉的溶液没有变色 | 猜想①成立 |
| (2)分别将少量优质珍珠粉和廉价珍珠粉放入试管中,加少量水,过滤, ,加热。 | 优质珍珠粉的溶液有黄色出现,局部变黑,廉价珍珠粉的溶液没有明显现象 | 猜想 成立 |
| | 优质珍珠粉 | 廉价珍珠粉 |
| 珍珠粉的质量 | 100g | 100g |
| 加入盐酸的质量 | 460.0g | 500g |
| 烧杯中最终物质的总质量 | 520.0g | 558.2g |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
化学兴趣小组在化学实验室发现了一瓶已部分变质的氢氧化钠溶液,想测试它的变质情况。小组同学取10g该溶液放入烧杯中,然后将20g稀盐酸分4次加入同一个烧杯中充分反应,反应后称量质量。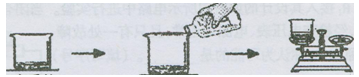
变质的 分四次 每次反应后
NaOH溶液 加入稀盐酸 称量质量
实验过程的数据记录如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 稀盐酸的质量(g) | 5 | 5 | 5 | 5 |
| 反应后烧杯内物质的质量 | 15 | 19.56 | 24.12 | 29.12 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(9分)实验室有一瓶硫酸溶液,老师请小红同学设计方案测定该废液中硫酸的质量分数。小红同学先取一洁净小烧杯,称其质量为18.2g,然后往其中倒入少量硫酸废液后称量,总质量为33.2g,之后,将一枚质量为10.8g的铁钉(已用砂纸打磨去年铁锈)放入该小烧杯中反应,待铁钉表面不再有气泡产生后,再次称量,总质量为43.9 g。
请回答下列问题:
(1)反应中产生的气体的质量是 。
(2)计算该废液中硫酸的质量分数(写出计算过程,计算结果保留一位小数)。(6分)
(3)如果铁钉的铁锈未除净,对计算结果的影响是 (选填“偏大”、“偏小”、“无影响”),原因是 。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(8分)
某化学兴趣小组使用下图所示装置,对某种锌铜合金的成分进行测量。先取足量稀硫酸于烧杯中,再向其中加入15.0g合金样品开始计时,并将电子天平的读数记录在下表中,完成下列计算:
(1)反应完全后产生氢气的质量是多少?
(2)锌铜合金中铜的质量是多少?
(3)反应完全后溶液中溶质的质量分数是多少?
| | 空烧杯 | 加入硫酸后 | 加入合金后 5分钟 | 加入合金后 10分钟 | 加入合金后 30分钟 |
| 读数(g) | 21.3 | 169.7 | 184.6 | 184.3 | 184.3 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(8分)某同学称取a g铜锌合金,加入足量稀硫酸,充分反应后测得生成气体的质量为b g,剩余固体经过滤、洗涤、干燥后,称得质量为c g.请问:
(1)a g铜锌合金中锌的质量为 g(用代数式表示).
(2)根据化学反应方程式,推导出a、b、c三者之间的等量关系(写出详细的计算推导过程).
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
我国约在南北朝时就开始冶炼黄铜,黄铜是铜和锌的合金(Cu-Zn),它可用来制造电器零件及日用品。小华利用一瓶稀盐酸和相关的仪器,测定黄铜样品的组成(不考虑黄铜中的其他杂质)。将30mL稀盐酸分三次加入到10g黄铜样品粉末中,每次充分反应后,测定生成氢气的质量,实验数据见下表:
(1)从上表数据分析,小华用10g合金粉末总共收集到氢气 g;
(2)求该合金中铜的质量分数。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com