
【题目】实验与探究是化学学习的重要方法和内容.
(1)今年5月,我校进行了实验操作考查.小张同学进行的实验考查是“用稀盐酸鉴别氢氧化钠(NaOH)溶液和碳酸钠(Na2CO3)溶液,并测定碳酸钠溶液的pH”.
①小张同学的实验记录如下表,请补充完整:
操作步骤 | 现象记录 | 反应的化学方程式 |
取两支试管,分别往试管中加入2mL样品,再往其中滴入盐酸 | 样品1:无明显现象 | |
样品2: |
②小张用pH试纸测定碳酸钠溶液的酸碱度时,先将试纸用蒸馏水湿润,再将被测试液滴在试纸上.你认为他的做法是否正确?
(2)在实验台上有三瓶未贴标签的溶液,已知分别是硫酸钠溶液、氢氧化钡溶液和稀盐酸.为区别这三种溶液,在老师指导下,兴趣小组的同学把这三种溶液按A、B、C进行编号,然后分别各取适量作为样品加入到三支试管中,进行了如图所示的探究活动: 
【步骤一】中:A、B溶液的颜色无变化,C溶液变成红色;
【步骤二】中:滴入A后溶液的颜色由红色变成无色.当恰好变成无色时,溶液中含有的溶质主要是(酚酞除外).滴入B后,溶液仍显红色,且出现 .
①根据上述实验现象可知,B、C溶液分别是、 .
②实验结束后,该小组的同学欲将废液直接倒入下水道,老师迅速制止.请你解释原因: .
【答案】
(1)NaOH+HCl=NaCl+H2O;溶液中出现气泡;Na2CO3+2HCl=2NaCl+H2O+CO2↑;不正确
(2)氯化钡;白色沉淀;硫酸钠;氢氧化钡;废液会腐蚀下水道,污染水体
【解析】解:(1)①稀盐酸与氢氧化钠反应生成氯化钠和水,与碳酸钠反应生成氯化钠、水和二氧化碳气体,其反应方程式为:样品1:NaOH+HCl=NaCl+H2O;样品2:Na2CO3+2HCl=2NaCl+H2O+CO2↑; ②用pH试纸测定所配制溶液的pH值的方法是:在白瓷板或玻璃片上放一小片pH试纸,将被测液滴到试纸上,把试纸显示的颜色与标准比色卡比较,即可得出该溶液的pH值,测定前一定不能用水润湿PH试纸,这样会使得测定结果不准确.(2)氢氧化钡溶液显碱性,所以它们都能使无色酚酞试液变红;稀盐酸显酸性,不能使无色酚酞试液变色,硫酸钠溶液显中性,也不能使酚酞变色.
所以,步骤一中,C溶液变成红色,说明C是氢氧化钡溶液;A、B溶液不变色,说明A、B溶液是硫酸钠溶液、盐酸;步骤二中,“滴入A溶液的颜色由红色变成无色”说明这C溶液与A稀盐酸反应,经过推断可知A是稀盐酸,滴入B后溶液仍显红色,且生成白色沉淀,说明B为硫酸钠溶液;废液中含有酸或碱及有毒的重金属离子,会腐蚀下水道,污染水体,故不能随意倾倒;所以答案是:(1)①NaOH+HCl=NaCl+H2O;溶液中出现气泡;Na2CO3+2HCl=2NaCl+H2O+CO2↑;②不准确;(2)【步骤二】氯化钡;白色沉淀;硫酸钠;氢氧化钡;废液会腐蚀下水道,污染水体.
【考点精析】掌握书写化学方程式、文字表达式、电离方程式是解答本题的根本,需要知道注意:a、配平 b、条件 c、箭号.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:初中化学 来源: 题型:
【题目】某化学制剂厂甲、乙、丙、丁四个车间排放的废水中,主要成分分别含有CuCl2、HCl、Na2CO3、NaOH中的一种.从环保角度考虑,该厂决定综合处理废水:通过调节废水流量,使乙、丁两车间废水相对过量,最终排出的溶液呈中性.处理过程如图所示.请回答: 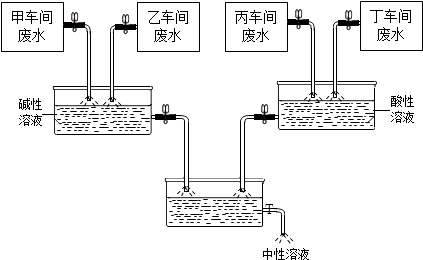
(1)甲、丙、丁三车间排放的废水中,主要成分是:甲车间: , 丙车间: , 丁车间 .
(2)用来检测最终排出的溶液已呈中性.
(3)请具体说明在处理过程中,乙车间和丁车间排出的废水相对过量的目的是: .
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据下列实验回答: 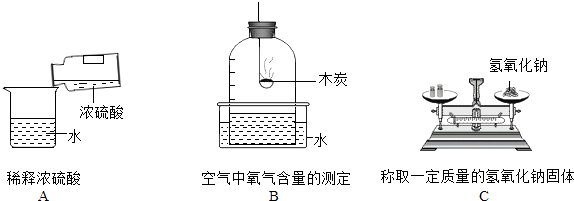
①图A中的操作错误是 .
②用图B的方法测定空气中氧气的体积分数,会使结果偏低,改进的措施是 .
③图C称量氢氧化钠固体的方法有处错误.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列实验操作中,正确的是
A. 配制稀硫酸时,可先在量筒中加入一定量的浓硫酸,再慢慢注入水并不断搅拌
B. 蒸发实验中,当蒸发皿内的液体完全蒸干后,立即停止加热
C. 用漏斗过滤液体时,液面稍高于滤纸边缘
D. 检查装置气密性时,应先把导管一端放入水中,再双手紧捂试管
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列各组离子在水中一定能大量共存,并形成无色透明溶液的是
A.Ba2+、OH-、SO42-B. H+、K+、HCO3-
C.Ca2+、H+、NO3-D. K+、NH4+、OH-、
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com