氧化铝(Al
2O
3)、氮化铝(AlN)都是一种重要的无机非金属材料,广泛应用于矿业生产和集成电路生产领域,某化学小组进行氮化铝的制备并测定其含量的实验如图.
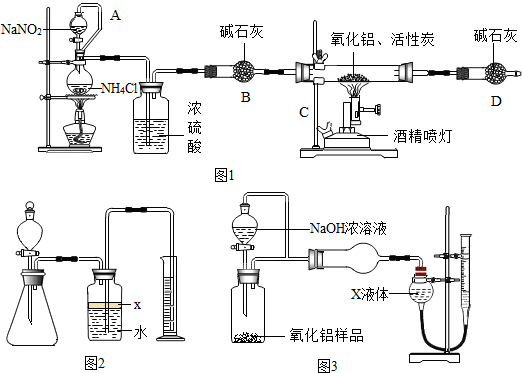
【实验一】:制备氮化铝
【资料卡1】实验室常用饱和亚硝酸钠与氯化铵溶液反应制取纯净的氮气.反应的化学方程式为:
NaNO
2+NH
4Cl=NaCl+N
2+2H
2O(此反应是放热反应),Al
2O
3+3C+N
22AlN+3CO
试回答:
(1)装置中A部分的分液漏斗与蒸馏瓶之间连接的导管所起的作用是
(填编号)
A.防止NaNO
2饱和溶液蒸发 B.保证实验装置不漏气 C.使NaNO
2饱和溶液容易滴下
(2)加入药品前必须进行的一个实验步骤是
,加热片刻后,即应移去酒精灯以防反应物冲出,其原因是
;
(3)上述实验装置存在一些不足,请指出
;
(4)在制取氮化铝时由于反应不完全,氮化铝产品中所含杂质除了氧化铝以外还可能存在
(填化学式).
【实验二】含量测定
【资料卡2】已知氮化铝和NaOH溶液能反应,其反应方程式为:
①AlN+NaOH+H
2O=NaAlO
2+NH
3↑
②氧化铝也能与氢氧化钠溶液反应而全部溶解,但不生成气体.
现用图二中所示的一些装置来进行相关实验,根据反应中所生成氨气的体积来测定样品中的氮化铝的质量分数,(实验中导管体积忽略不计).
(1)实验操作为:a、往锥形瓶中放入适量的AlN样品;b、打开分液漏斗的活塞往锥形瓶中加入过 量的浓NaOH;c、检验装置气密性;d、测定收集到水的体积.正确的操作顺序为:
(用a、b、c、d字母表示).
(2)广口瓶中的试剂x宜选用
(填写序号).
A.稀硫酸 B.酒精 C.植物油 D.水
(3)若广口瓶内的液体没有装满(上方留有少量空间),则实验测得 NH
3体积将
(选填“偏大”、“偏小”或“无影响”).
(4)老师指导小组的学生说,这种装置测定AlN的质量分数,会引起测定值偏高,理由是:
.
【数据处理】实验小组用改进装置(图三),称取10.00g样品,测得氨气3.36L(标准状况).则该样品中的AlN的质量分数为
.(写出计算过程,共3分)(氨气的密度为:0.7588g/L).
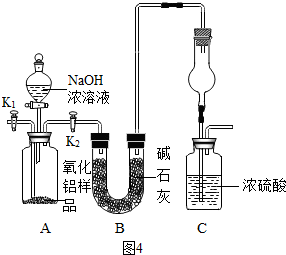
【拓展提高】查阅资料得知,氨气能被硫酸吸收,反应如下:2NH
3+H
2SO
4═(NH
4)
2SO
4若改用如图4装置进行同样实验,通过测定装置C中浓硫酸的增重来确定样品中AlN的质量分数.C装置中的干燥管作用是
,你认为测定的结果会
(填“偏高”或“偏低”).