
化学小组的同学探究二氧化碳氢氧化钠的反应,实验方案如下:
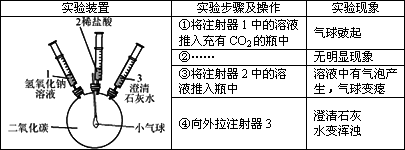
(1)步骤①中气球鼓起的原因可能是________.
(2)步骤②中的操作是________,其目的是________.
(3)步骤④中发生反应的化学方程式为________.
(4)本实验的结论是________.
科目:初中化学 来源: 题型:
| 实验目的 | 实验操作 | 实验现象 | 实验结论 |
| 证明粉末中是否含有 铝 |
取一个小烧杯,加入适量的粉末,再向其中加入足量的 氢氧化钠溶液 |
无明显变化 |
猜想四成立; 实验中发生反应 的化学方程式为 Fe+2HCl=FeCl2+H2↑ |
| 证明粉末中是否含有 铁、铜 |
过滤,将得到的固体洗涤后放入小烧杯,再向其中加入足量的稀盐酸 | ①有气泡产生 ②固体未完全溶解 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
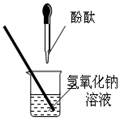 24、同学们在探究碱溶液与酚酞溶液作用的实验时,发现了一个意外现象:向氢氧化钠溶液中滴入酚酞溶液(如图),溶液变成了红色,但是一会儿红色就消失了.为此某化学小组的同学进行了如下探究.
24、同学们在探究碱溶液与酚酞溶液作用的实验时,发现了一个意外现象:向氢氧化钠溶液中滴入酚酞溶液(如图),溶液变成了红色,但是一会儿红色就消失了.为此某化学小组的同学进行了如下探究.| 实验步骤 | 实验目的 | 现象结论 |
| ①用煮沸过的蒸馏水配制某氢氧化钠溶液. | 排出水中溶解的氧气 | 溶液先变成红色,一会儿红色又消失. 丙同学的猜想不正确. |
| ②取少量上述氢氧化钠溶液,滴入酚酞,然后在上方滴一些植物油. | 隔绝空气 |
查看答案和解析>>
科目:初中化学 来源: 题型:
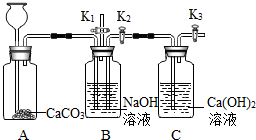 (2013?顺义区二模)化学小组的同学设计了下图所示装置,用以探究碱的有关性质.
(2013?顺义区二模)化学小组的同学设计了下图所示装置,用以探究碱的有关性质.查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 实验目的 | 实验操作 | 实验现象 |
| ①证明粉末中是否含有铜 | 取一个小烧杯,加入适量的粉末,再向其中加入足量的 稀盐酸或稀硫酸 稀盐酸或稀硫酸 . |
有少量红色粉末不能溶解. |
| ②证明粉末中是否含有 | 取5.5克粉末放入烧杯,再向其中加入适量的硫酸亚铁溶液,反应完全后过滤、干燥,称量固体为5.52克. | 浅绿色溶液变为浅粉色. 浅绿色溶液变为浅粉色. |
| ③证明粉末中是否含有铁 | 另取5.5克粉末, 用磁铁充分吸引 用磁铁充分吸引 (用物理方法),称量剩余金属粉末为1.12克. |
有大量黑色粉末被磁铁吸引. 有大量黑色粉末被磁铁吸引. |
查看答案和解析>>
科目:初中化学 来源:2011年上海市黄浦区中考化学二模试卷(解析版) 题型:选择题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com